Фармакологическое действие. Физико-химические и химические механизмы действия лекарственных веществ. Стратегия индивидуальной лекарственной терапии
Блокатор H 1 -гистаминовых рецепторов первого поколения. Действие на центральную нервную систему обусловлено блокадой H 3 -гистаминовых рецепторов мозга и угнетением центральных холинергических структур. Снимает спазм гладкой мускулатуры (непосредственное действие), уменьшает проницаемость капилляров, предупреждает и ослабляет аллергические реакции, обладает местноанестезирующим, противорвотным, седативным эффектами, умеренно блокирует холинорецепторы вегетативных ганглиев, оказывает снотворное действие.
Показания- анафилактические и анафилактоидные реакции (в комплексной терапии);-отек Квинке;
Сывороточная болезнь;- другие острые аллергические состояния (в комплексной терапии и в тех случаях, когда использование таблетированной формы невозможно).
Побочные действия
Со стороны нервной системы: сонливость, слабость, снижение скорости психомоторной реакции, нарушения координации движений, головокружение, тремор, раздражительность, эйфория, возбуждение (особенно у детей), бессонница.
Со стороны дыхательной системы: сухость слизистой оболочки полости рта, носа, бронхов (повышение вязкости мокроты).
Со стороны органов кроветворения: гемолитическая анемия, тромбоцитопения, агранулоцитоз.
Со стороны сердечно-сосудистой системы: снижение АД, тахикардия, экстрасистолия.
Со стороны мочевыделительной системы: нарушение мочеиспускания.
Аллергические реакции: крапивница, фоточувствительность, кожная сыпь, зуд.
Лоратадин(кларитин)
Фармакологическое действие
Противоаллергический препарат, селективный блокатор периферических гистаминовых H 1 -рецепторов. Лоратадин представляет собой трициклическое соединение с выраженным антигистаминным действием. Обладает быстрым и длительным противоаллергическим действием.
Лоратадин не проникает через ГЭБ и не оказывает воздействия на ЦНС. Не оказывает клинически значимого антихолинергического или седативного действия, т.е. не вызывает сонливости и не влияет на скорость психомоторных реакций при применении в рекомендованных дозах. Прием препарата Кларитин не приводит к удлинению интервала QT на ЭКГ. При длительном лечении не наблюдалось клинически значимых изменений показателей жизненно важных функций, данных физикального осмотра, результатов лабораторных исследований или ЭКГ.
Лоратадин не обладает значимой селективностью в отношении гистаминовых Н 2 -рецепторов. Не ингибирует обратный захват норэпинефрина и практически не оказывает влияния на сердечно-сосудистую систему или функцию водителя ритма
Побочные действия
Со стороны нервной системы: у детей в возрасте от 2 до 12 лет - головная боль (2.7%), нервозность (2.3%), утомляемость (1%); у взрослых - головная боль (0.6%), сонливость (1.2%), бессонница (0.1%).
у взрослых - повышение аппетита (0.5%).
В постмаркетинговом периоде
Со стороны нервной системы: очень редко (< 1/10 000) - головокружение, утомляемость.
Со стороны пищеварительной системы: очень редко (< 1/10 000) - сухость во рту, желудочно-кишечные расстройства (тошнота, гастрит), нарушение функции печени.
Аллергические реакции: очень редко (< 1/10 000) - сыпь, анафилаксия.
Со стороны сердечно-сосудистой системы: очень редко (< 1/10 000) - сердцебиение, тахикардия.
Со стороны кожных покровов: очень редко (< 1/10 000) - алопеция.
Показания
Сезонный (поллиноз) и круглогодичный аллергические риниты и аллергический конъюнктивит (для устранения симптомов, связанных с этими заболеваниями - чиханья, зуда слизистой оболочки носа, ринореи, ощущения жжения и зуда в глазах, слезотечения);- хроническая идиопатическая крапивница;- кожные заболевания аллергического происхождения.
33. Средства, устраняющие общие проявления аллергических реакций типа анафилактического шока. Эпинефрин, Эуфиллин, преднизоллон. Основные фармакологические эффекты, цель назначения каждого препарата и нежелательные эффекты.
ПРОТИВОАЛЛЕРГИЧЕСКИЕ СРЕДСТВА (antiallergica; син. десенсибилизирующие средства) - лекарственные средства, предупреждающие или ослабляющие проявления аллергических реакций. Одним из возможных путей предупреждения и лечения аллергических реакций является метод так наз. специфической гипосенсибилизации, т. е. понижения чувствительности организма к какому-либо антигену путем многократного введения самого антигена в низких дозах, не вызывающих проявлений аллергии. При этом организм постепенно утрачивает чувствительность к вводимому антигену.
Адреналин
Фармакологическое действие Адреномиметик, оказывает прямое стимулирующее действие на α- и β-адренорецепторы. Под действием эпинефрина (адреналина) вследствие стимуляции α-адренорецепторов происходит увеличение содержания внутриклеточного кальция в гладких мышцах. повышает активность фосфолипазы С (через стимуляцию G-белка) и образование инозитолтрифосфата и диацилглицерола. Оказывает выраженное действие на сердечно-сосудистую систему. Увеличивает частоту и силу сердечных сокращений, ударный и минутный объем сердца. Улучшает AV-проводимость, повышает автоматизм. Увеличивает потребность миокарда в кислороде. Вызывает сужение сосудов органов брюшной полости, кожи, слизистых оболочек, в меньшей степени - скелетных мышц. Повышает АД (главным образом систолическое) , Эпинефрин (адреналин) расслабляет гладкие мышцы бронхов, понижает тонус и моторику ЖКТ, расширяет зрачки, способствует понижению внутриглазного давления. Вызывает гипергликемию и повышает содержание в плазме свободных жирных кислот. Показания Аллергические реакции немедленного типа (в т. ч. крапивница, ангионевротический шок, анафилактический шок) , развивающиеся при применении лекарственных средств, сывороток, переливании крови, употреблении пищевых продуктов, укусах насекомых или введении других аллергенов. Бронхиальная астма (купирование приступа) , бронхоспазм во время наркоза. С целью остановки кровотечения. Побочное действие Со стороны сердечно-сосудистой системы: стенокардия, брадикардия или тахикардия, сердцебиение, повышение или снижение АД; при применении в высоких дозах - желудочковые аритмии; редко - аритмия, боль в грудной клетке. Со стороны нервной системы: головная боль, тревожное состояние, тремор, головокружение, нервозность, усталость, психоневротические расстройства
Эуфиллин
Фармакологическое действие
Бронхолитическое средство, производное ксантина; ингибирует фосфодиэстеразу, увеличивает накопление в тканях циклического аденозинмонофосфата, блокирует аденозиновые (пуриновые) рецепторы; снижает поступление ионов кальция через каналы клеточных мембран, уменьшает сократительную активность гладкой мускулатуры. Расслабляет мускулатуру бронхов, увеличивает мукоцилиарный клиренс, стимулирует сокращение диафрагмы, улучшает функцию дыхательных и межреберных мышц, стимулирует дыхательный центр, повышает его чувствительность к углекислому газу и улучшает альвеолярную вентиляцию, что в конечном итоге приводит к снижению тяжести и частоты эпизодов апноэ. Нормализуя дыхательную функцию, способствует насыщению крови кислородом и снижению концентрации углекислоты. Оказывает стимулирующее влияние на деятельность сердца, увеличивает силу и число сердечных сокращений, повышает коронарный кровоток и потребность миокарда в кислороде. Снижает тонус кровеносных сосудов (главным образом, сосудов мозга, кожи и почек). Оказывает периферическое венодилатирующее действие, уменьшает легочное сосудистое сопротивление, снижает давление в «малом» круге кровообращения. Увеличивает почечный кровоток, оказывает умеренный диуретический эффект. Расширяет внепеченочные желчные пути. Тормозит агрегацию тромбоцитов (подавляет фактор активации тромбоцитов и PgE2 альфа), повышает устойчивость эритроцитов к деформации (улучшает реологические свойства крови), уменьшает тромбообразование и нормализует микроциркуляцию. Обладает токолитическим действием, повышает кислотность желудочного сока. При использовании в больших дозах обладает энилептогенным действием.
Побочные действия
Со стороны нервной системы : головокружение, головная боль, бессонница, возбуждение, тревожность, раздражительность, тремор.
Со стороны сердечно-сосудистой системы: сердцебиение, тахикардия (в том числе у плода при приеме беременной в III триместре), аритмии, кардиалгия, снижение артериального давления, увеличение частоты приступов стенокардии.
Со стороны пищеварительной системы : гастралгия, тошнота, рвота, гастроэзофагеальный рефлюкс, изжога, обострение язвенной болезни, диарея, при длительном приеме - снижение аппетита.
Аллергические реакции: кожная сыпь, зуд, лихорадка.
Прочие: боль в груди, тахипноэ, ощущение приливов к лицу, альбуминурия, гематурия, гипогликемия, усиление диуреза, повышенное потоотделение.
Показания
Бронхообструктивный синдром любого генеза: бронхиальная астма (препарат выбора у больных с астмой физического напряжения и как дополнительное средство при др. формах), хроническая обструктивная болезнь легких, эмфизема легких, хронический обструктивный бронхит, легочная гипертензия, «легочное» сердце, ночное апноэ.
Преднизолон
Фармакологическое действие
Синтетический ГКС. Обладает выраженным противовоспалительным действием. Препарат тормозит развитие симптомов воспаления. Тормозит накопление макрофагов, лейкоцитов и других клеток в зоне воспаления. Угнетает фагоцитоз, высвобождение микросомальных ферментов, а также синтез и высвобождение медиаторов воспаления. Вызывает уменьшение проницаемости капилляров, торможение миграции лейкоцитов.
Усиливает синтез липомодулина, ингибитора фосфолипазы А2, высвобождающей арахидоновую кислоту из фосфолипидных мембран с одновременным ингибированием ее синтеза.
Механизм иммунодепрессивного действия преднизолона до конца не изучен. Препарат уменьшает количество Т-лимфоцитов, моноцитов и ацидофильных гранулоцитов, а также связывание иммуноглобулинов с рецепторами на поверхности клеток, тормозит синтез или высвобождение интерлейкинов путем уменьшения бластогенеза Т-лимфоцитов; уменьшает ранний иммунологический ответ. Тормозит также проникновение иммунологических комплексов через мембраны и уменьшает концентрацию компонентов комплемента и иммуноглобулинов.
Преднизолон действует на дистальную часть почечных канальцев, усиливая обратное всасывание натрия и воды, а также увеличение выделения калия и ионов водорода.
Преднизолон ингибирует секрецию АКТГ гипофизом, что приводит к уменьшению выработки кортикостероидов и андрогенов корой надпочечников. После длительного применения препарата в высоких дозах функция надпочечников может восстанавливаться в течение года, а в некоторых случаях развивается стойкое подавление их функции. Преднизолон усиливает катаболизм белков и индуцирует ферменты, участвующие в метаболизме аминокислот. Тормозит синтез и усиливает катаболизм белков в лимфатической, соединительной, мышечной ткани. При длительном применении возможно развитие атрофии этих тканей (а также кожи).
Повышает концентрацию глюкозы в крови путем индукции ферментов глюконеогенеза в печени, стимуляции катаболизма белков (что увеличивает количество аминокислот для глюконеогенеза) и уменьшения потребления глюкозы в периферических тканях. Это приводит к накоплению гликогена в печени, повышению концентрации глюкозы в крови и повышению резистентности к инсулину.
Показания
Эндокринологические заболевания:
Недостаточность коры надпочечников: первичная (болезнь Аддисона) и вторичная; - адреногенитальный синдром (врожденная гиперплазия надпочечников); - острая недостаточность коры надпочечников;
Перед хирургическими вмешательствами и при тяжелых заболеваниях и травмах у пациентов с недостаточностью надпочечников; - подострый тиреоидит.
Тяжелые аллергические заболевания, резистентные к другой терапии:- контактный дерматит; - атопический дерматит; - сывороточная болезнь; - реакции повышенной чувствительности к лекарственным средствам;
Постоянный или сезонный аллергический ринит; - анафилактический реакции; - ангионевротический отек.
Ревматические заболевания:
Ревматоидный артрит, ювенильный ревматоидный артрит (в случаях резистентный к другим методам лечения);
Дерматологические заболевания:- эксфолиативный дерматит;- герпетиформный буллезный дерматит;
Тяжелый себорейный дерматит;- тяжелая мультиформная эритема (синдром Стивенса-Джонсона);
Побочные действия
При кратковременном применении преднизолона (как и других ГКС) побочные эффекты наблюдаются редко. При применении преднизолона в течение длительного времени возможно развитие следующих побочных эффектов.
Со стороны водно-электролитного баланса: задержка в организме натрия и жидкости, гипокалиемия.
Со стороны костно-мышечной системы: мышечная слабость, стероидная миопатия, потеря мышечной массы, остеопороз, компрессионный перелом позвоночника.
Со стороны пищеварительной системы: стероидная язва с возможным прободением и кровотечением, панкреатит, метеоризм, язвенный эзофагит, нарушение пищеварения, тошнота, повышенный аппетит.
Дерматологические реакции: атрофия кожи, стрии, угри, замедленное заживление ран, истончение кожи, петехии, гематомы, эритема, повышенное потоотделение, аллергический дерматит, крапивница, ангионевротический отек.
Со стороны ЦНС и периферической нервной системы: повышение внутричерепного давления с синдромом застойного соска зрительного нерва (возникает чаще всего у детей, после слишком быстрого снижения дозы, симптомы – головная боль, ухудшение остроты зрения, двоение в глазах); судороги, головокружение, головная боль, нарушения сна.
Со стороны эндокринного статуса: вторичная надпочечниковая и гипоталамо-гипофизарная недостаточность (особенно во время стрессовых ситуаций: болезнь, травма, хирургическая операция); синдром Кушинга.
Прочие: анафилактические реакции, реакции гиперчувствительности; облитерирующий артериит, увеличение массы тела, обмороки.
1. Сущность фармакологии как науки. Разделы и области современной фармакологии. Основные термины и понятия фармакологии – фармакологическая активность, действие, эффективность химических веществ.
Фармакология – наука о лекарствах во всех аспектах – теоретическая основа терапии:
а) наука о взаимодействии химических веществ с живыми системами
б) наука об управлении процессами жизнедеятельности организма с помощью химических веществ
Развитие фармакологии идет по двум главным направлениям: фундаментальные исследования для выяснения принципов и механизмов действия ЛС и разработка эффективных препаратов как основы лечения заболеваний.
Фармакологию подразделяют на:
1. Общую - изучает общие закономерности взаимодействия лекарственных веществ с живыми организмами.
Частную – рассматривает конкретные фармакологические группы и отдельные препараты
2. Экспериментальную (базисную) фармакологию – изучает действие лекарств в эксперименте.
Клиническую фармакологию – изучает клиническую эффективность и безопасность
применения лекарств у пациентов, оптимизирует программу лечения пациента с учетом
его состояния.
Токсикологию – изучает токсическое действие на органы различных веществ (в том числе
и лекарственных).
Разделы современной фармакологии:
1) фармакодинамика – изучает а) воздействие ЛС на организм человека, б) взаимодействие различных ЛС в организме при одновременном их назначении, в) влияние возраста и различных заболеваний на действие ЛС
2) фармакокинетика – изучает всасывание, распределение, метаболизм и экскрецию ЛС (т.е. как организм больного реагирует на ЛС)
3) фармакогенетика – изучает роль генетических факторов в формировании фармакологического ответа организма на ЛС
4) фармакоэкономика – оценивает результаты использования и стоимость ЛС для принятия решения о последующем их практическом применении
5) фармакоэпидемиология – изучает применение ЛС и их эффекты на уровне популяций или больших групп людей для обеспечения применения наиболее эффективных и безопасных ЛС
Основные термины и понятия :
Фармакологическая (биологическая) активность – свойство вещества вызывать изменения в биосистеме (организме человека). Фармакологические вещества = биологически активные вещества (БАВ)
Фармакологическое действие – влияние ЛС на объект и его мишени
Фармакологический эффект – результат действия вещества в организме (модификация физиологических, биохимических процессов, морфологических структур) – количественное, но не качественное изменение в состоянии биосистем (клеток, тканей, органов).
Эффективность ЛС – способность ЛС вызывать определенные необходимые в данном случае фармакологические эффекты в организме. Оценивается на основе «существенных доказательств» - адекватных хорошо контролируемых исследований и клинических испытаний, проводимых экспертами с соответствующей научной подготовкой и опытом в исследовании лекарств данного типа {FDA}
2. Источники и этапы создания лекарств. Лекарства – генерики, плацебо - эффекты Определение понятий лекарственное вещество, лекарственное средство, лекарственный препарат и лекарственная форма.
Источники создания ЛС:
а) натуральное сырье: растения, животные, минералы, Продукты жизнедеятельности микроорганизмов {сердечные гликозиды, свиной инсулин, АБ}
б) модифицированные природные БАВ
в) продукты химического синтеза (методы: фармакологический скрининг, молекулярное конструирование, воспроизведение биогенных аминов, целенаправленная модификация молекул с уже известной активностью, синтез фармакологически активных метаболитов, случайные находки («серендипитный» метод))
г) продукты генной инженерии {рекомбинантный инсулин, интерфероны}
Этапы создания ЛС:
1. Синтез ЛС в химической лаборатории
2. Доклиническая оценка активности и нежелательных эффектов ЛС Минздравов и др. организмациями
3. Клинические испытания ЛС Экспертиза документации Фармакологическим комитетом проводится после завершения каждой фазы. Лекарство может быть отозвано на любом этапе. (I фаза – оценка переносимости на здоровых добровольцах 20-25 лет, II фаза – на больных добровольцах численностью менее 100 человек, страдающих определенным заболеванием, III фаза - мультицентровые клинические исследования на больших группах людей (до 1000 человек), IV фаза – мониторинг препарата на протяжении 5 лет после его официального разрешения (выполняют на большом числе пациентов (не менее 1.000-5.000 человек). После завершения III фазы клинических испытаний документация вновь поступает в Фармакологический комитет (объем полного досье может составлять до 1 млн. страниц) и в течение 1-2 лет регистрируется в Государственном реестре лекарственных средств и изделий медицинского назначения. Только после этого фармакологический концерн имеет право начать промышленный выпуск лекарственного средства и его распространение через аптечную сеть.
Лекарство-генерик – это непанентованный лекарственный препарат, являющийся воспризведением оригинального препарата, на действующее вещество которого истек срок патентной защиты. Может отличаться от оригинального препарата по составу вспомогательных веществ. Необходимое требование для продажи генериков – доказательная фармацевтическая, биологическая и терапевтическая эквивалентность исходному препарату. Генериковые лекарства всегда дешевле их брендовых аналогов, т.к. фирма не тратит средства на 10-15 летние исследования лекарства, а пользуется готовыми данными
Плацебо – любой компонент терапии, не оказывающий никакого специфического биологического воздействия на болезнь, являющуюся объектом лечения.
Применяется с целью контроля при оценке действия ЛС и для того, чтобы принести пользу больному без каких-либо фармакологических средств в результате только психологического воздействия (т.е. плацебо-эффекта ).
Все виды лечения имеют психологический компонент, либо доставляющий удовлетворения (плацебо-эффект ), либо вызывающий беспокойство (ноцебо-эффект ). Пример плацебо-эффекта: быстрое улучшение у больного вирусной инфекцией при применении антибиотиков. Благоприятность плацебо-эффекта связана с психологическим воздействием на пациента. Он будет максимальным лишь при его использовании в сочетании с методами лечения , имеющими выраженный специфический эффект. Дорогостоящие вещества в качестве плацебо также способствуют достижению большего ответа.
Показания к применению плацебо:
1) слабые психические нарушения
2) психологическая поддержка пациента с неизлечимой хронической болезнью или с подозрением на тяжелый диагноз
Лекарственное средство – любое вещество или продукт, используемые, чтобы модифицировать или исследовать физиологические системы или патологические состояния для блага реципиента (по ВОЗ, 1966 г.); индивидуальные вещества, смеси веществ или композиции неизвестного состава, обладающие доказанными лечебными свойствами.
Лекарственное вещество – индивидуальное химическое соединение, используемое в качестве лекарственного средства.
Лекарственная форма – удобная для практического применения форма, придаваемая лекарственному средству для получения необходимого лечебного или профилактического эффекта.
Лекарственный препарат – лекарственное средство в определенной лекарственной форме, разрешенное органом государственного управления.
Например: лекарственным веществом является антибиотик ампициллин, лекарственным средством – ампициллина тригидрат, который может выпускаться в форме таблеток или капсул. Лекарственным препаратом являются таблетки ампициллина тригидрата по 0,25 г.
Пути введения лекарств в организм и их характеристика. Пресистемная элиминация лекарств.
а. энтеральный путь введения: перорально, сублингвально, трансбуккально, ректально, через зонд б. парентеральный путь введения: внутривенно, подкожно, внутримышечно,… 2. Для местного воздействия: накожно (эпикутарно), на слизистые, в полости (брюшную, плевральную, суставную), в ткани…Перенос лекарств через биологические барьеры и его разновидности. Основные факторы, влияющие на перенос лекарств в организме.
1) Фильтрация (водная диффузия) – пассивное перемещение молекул вещества по градиенту концентрации через заполненные водой поры в мембране каждой… 2) Пассивная диффузия (липидная диффузия) - основной механизм переноса ЛВ,… 3) Транспорт при помощи специфических переносчиков – перенос ЛВ при помощи встроенных в мембрану переносчиков (чаще…Перенос через мембраны лекарственных веществ с переменной ионизацией (уравнение ионизации Гендерсона-Гассельбальха). Принципы управления переносом.
Все ЛС - слабые кислоты или слабые основания, имеющие свои значения константы ионизации (рК). Если значение рН среды равно значению рК лекарства, то 50% его молекул будет находится в ионизированном и 50% в неионизированном состоянии и среда для лекарства будет нейтральной.
В кислой среде (рН меньше рК), там где имеется избыток протонов, слабая кислота будет находиться в недиссоциированной форме (R-COOH), т.е. будет связана с протоном – протонирована. Такая форма кислоты незаряжена и хорошо растворима в липидах. Если рН сместиться в щелочную сторону (т.е. рН станет больше рК), то кислота начнет диссоциировать и лишится протона, перейдя при этом в непротонированную форму, которая имеет заряд и плохо растворима в липидах.
В щелочной среде, там где имеется дефицит протонов, слабое основание будет находиться в недиссоциированной форме (R-NH 2), т.е. будет непротонировано и лишено заряда. Такая форма основания хорошо растворима в липидах и быстро абсорбируется. В кислой среде имеется избыток протонов и слабое основание начнет диссоциировать, связывая при этом протоны и образуя протонированную, заряженную форму основания. Такая форма плохо растворима в липидах и слабо абсорбируется.
Следовательно, абсорбция слабых кислот протекает преимущественно в кислой среде, а слабых оснований – в щелочной.
Особенности метаболизма слабых кислот (СК):
1) желудок: СК в кислом содержимом желудка неионизирована, а в щелочной среде тонкого кишечника она будет диссоциациировать и молекулы СК приобретут заряд. Поэтому, абсорбция слабых кислот будет наиболее интенсивной в желудке.
2) в крови среда достаточно щелочная и всосавшиеся молекулы СК перейдут в ионизированную форму. Фильтр клубочков почек пропускает как ионизированные, так и неионизированные молекулы, поэтому, несмотря на заряд молекулы, СК будут выводиться в первичную мочу
3) если моча щелочная, то кислота останется в ионизированной форме, не сможет реабсорбироваться обратно в кровоток и выделится с мочой; мочи кислая, то лекарство перейдет в неионизированную форму, которая легко реабсорбируется обратно в кровь.
Особенности метаболизма слабых оснований : противоположно СК (абсорбция лучше в кишечнике; в щелочной моче подвергаются реабсорбции)
Т.о., чтобы ускорить выведение из организма слабой кислоты мочу необходимо ощелачивать, а чтобы ускорить выведение слабого основания ее необходимо подкислить (детоксикация по Попову).
Количественную зависимость процесса ионизации лекарства при различном рН среды позволяет получить уравнение Henderson-Hasselbach :
Где pKa соответствует значению pH, при котором концентрации ионизированной и неионизированной форм находятся в равновесии.
Уравнение Гендерсона-Гассельбаха позволяет оценить степень ионизации ЛС при данном значении рН и предсказать вероятность его проникновения через клеточную мембрану.
(1)Для разбавленной кислоты, A,
HA ↔ H + + A - , где HA – концентрация неионизированной (протонированной) формы кислоты и A - - концентрация ионизированной (непротонированной) формы.
(2) Дляслабого основания, B,
BH + ↔ H + + B, где BH + - концентрация протонированной формы основания, B - концентрация непротонированной формы
Зная рН среды и рКа вещества, можно по вычисленному логарифму определить степень ионизации лекарства, а значит, и степень его всасывания из желудочно-кишечного тракта, реабсорбции или экскреции почками при разных значениях рН мочи и т. д.
Принципы управлением переносом.
Для ускорения всасывания
Ø слабых кислот (АСК) – рН желудочного сока должен быть кислым;
Ø слабых основаный – рН желудочного сока должен быть нейтральным.
Для ускорения выведения
Ø слабых кислот – мочу подщелачивают;
Ø слабых оснований – мочу подкисляют.
Перенос лекарств в организме. Водная диффузия и диффузия в липидах (закон Фика). Активный транспорт.
Перенос ЛС в организме может осуществляться водной и липидной диффузией, активным транспортом, эндо- и пиноцитозом.
Особености перенос ЛС в организме водной диффузией:
1. Эпителиальные покровы (слизистые ЖКТ, полости рта и др.) – водная диффузия только очень малых молекул (метанол, ионы лития и т.д.)
2. Капилляры (кроме мозговых) – фильтрация веществ с молекулярной массой до 20-30 тыс. Да.
3. Капилляры мозга – в основном не имеют водных пор, за исключением областей гипофиза, эпифиза, зоны IV желудочка, хориоидного сплетения, медианного возвышения
4. Плацента – не имеет водных пор (хотя вопрос спорный).
5. Связывание ЛС с белками крови препятствует их выходу из кровяного русла, а значит, и водной диффузии
6. Диффузия в воде зависит от размеров молекул ЛС и водных пор
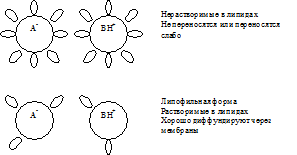
Особенности липидной диффузии:
1. Основной механизм переноса ЛС через клеточные мембраны
2. Определяется липофильностью диффундируемого вещества (т.е. коэффициентом распределения «масло/вода») и градиентом концентрации, может быть ограничена очень низкой растворимостью вещества в воде (что препятствует проникновению ЛС в водную фазу мембран)
3. Легко диффундируют неполярные соединения, трудно – ионы.
Любая диффузия (и водная, и в липидах) подчиняется закону диффузии Фика:
Скорость диффузии – количество переносимых в единицу времени молекул лекарства; С 1 - концентрация вещества снаружи мембраны;С 2 - концентрация вещества изнутри мембраны.
Следствие из закона Фика:
1) фильтрация ЛС тем выше, чем больше его концентрация в месте введения {S абсорбируемой поверхности в кишечнике больше, чем в желудке, поэтому абсорбция ЛС в кишечника более быстрая}
2) фильтрация ЛС тем выше, чем больше концентрация ЛС в месте введения
3) фильтрация ЛС тем выше, чем меньше толщина преодолеваемой биологической мембраны {толщина барьера в альвеолах легких значительно меньше, чем кожи, поэтому скорость абсорбции выше в легких}
Активный транспорт – перенос ЛC независимо от градиента концентрации с использованием энергии АТФ, характерен для гидрофильных полярных молекул, ряда неорганических ионов, сахаров, аминокислот, пиримидинов.
Характеризуется: а) избирательностью к определенным соединениям б) возможностью конкуренции двух веществ за один транспортный механизм в) насыщаемостью при высоких концентрациях вещества г) возможностью транспорта против градиента концентрации д) затратой энергии.
7. Центральный постулат фармакокинетики концентрация лекарства в крови – основной параметр для управления терапевтическим эффектом. Задачи, решаемые на основании знания этого постулата.
Центральный постулат (догма) фармакокинетики : концентрация ЛВ в плазме крови детерминирует (количественно определяет) фармакологический эффект.
В большинстве случаев скорость всасывания, распределения, метаболизма и экскреции ЛС пропорциональна их концентрации в плазме крови (подчиняется закону действующих масс), поэтому зная ее возможно:
1) определить период полуэлиминации (для ЛС с кинетикой первого порядка)
2) объяснить длительность некоторых токсических эффектов ЛС (для ЛС в высоких дозах с кинетикой насыщения)
[C]плазма→ [C]на мишени→ эффект
Определяются законами определяется з-нами фармодинамики
Распределения
Задачи: научиться управлять концентрацией лекарства в крови.
Фармакокинетические модели (однокамерная и двухкамерная), количественные законы всасывания и элиминации лекарств.
Весь организм – единый однородный контейнер. Допущения: 1) устанавливается быстрое динамическое развитие между содержанием препарата в… 2) ЛС быстро и равномерно распределяется по всему объему кровиРаспределение лекарств в организме. Отсеки, лиганды. Основные детерминанты распределения.
Отсеки распределения: 1. Внеклеточное пространство (плазма, межклеточная жидкость) 2. Клетки (цитоплазма, мембрана органелл)Константа элиминации, ее сущность, размерность, связь с другими фармакокинетическими параметрами.
Константа скорости элиминации (k el , мин -1) – показывает, какая часть ЛС элиминируется из организма в единицу времени Þ Kel = A выд /А общ, где А выд – количество ЛС, выделяемое в ед. времени, А общ – общее количество ЛС в организме.
Значение k el обычно находят путем решения фармакокинетического уравнения, описывающего процесс элиминации лекарства из крови, поэтому k el называют модельным показателем кинетики. Непосредственного отношения к планированию режима дозирования k el не имеет, но ее значение используют для расчета других фармакокинетических параметров.
Константа элиминации прямо пропорциональна клиренсу и обратно пропорционально объему распределения (из определения клиренса): Kel=CL/Vd; = час -1 /мин -1 =доля в час.
Период полувыведения лекарств, его сущность, размерность, взаимосвязь с другими фармакокинетическими параметрами.
Период полуэлиминации (t ½ , мин) – это время, необходимое для снижения концентрации ЛС в крови ровно наполовину. При этом не играет роли каким путем достигается снижение концентрации – при помощи биотрансформации, экскреции или же за счет сочетания обоих процессов.
Период полуэлиминации определяют по формуле:
![]()
Период полувыведения – важнейший фармакокинетический параметр, позволяющий:
б) определить время полной элиминации препарата
в) предсказать концентрацию ЛС в любой момент времени (для ЛС с кинетикой первого порядка)
Клиренс как главный параметр фармакокинетики для управления режимом дозирования. Его сущность, размерность и связь с другими фармакокинетическими показателями.
Клиренс (Cl, мл/мин) - объем крови, который очищается от ЛС за единицу времени.
Т.к. плазма (кровь) - «видимая» часть объема распределения, то клиренс – фракция объема распределения, из которой лекарство выделяется в единицу времени. Если обозначить общее количество лекарства в организме через А общ , а количество, которое выделилось через А выд , то:
С другой стороны, из определения объема распределения следует, что общее количество лекарства в организме составляет А общ =V d ´C тер/плазма . Подставляя это значение в формулу клиренса, мы получим:
![]() .
.
Таким образом, клиренс – отношение скорости выведения лекарственного средства к его концентрации в плазме крови.
В таком виде формулу клиренса используют для расчета поддерживающей дозы лекарства (D п ), т.е той дозы лекарственного средства, которая должна скомпенсировать потерю лекарства и поддержать его уровень на постоянном уровне:
Скорость введения = скорость выведения = Cl´C тер (доза/мин)
D п = скорость введения´t (t - интервал, между приемом лекарства)
Клиренс аддитивен , т.е. элиминация вещества из организма может происходить с участием процессов, идущих в почках, легких, печени и других органах: Cl системный = Cl почечн. + Cl печени + Cl др.
Клиренс связан с периодом полуэлиминации ЛС и объемом распределения : t 1/2 =0,7*Vd/Cl.
Доза. Виды доз. Единицы дозирования лекарственных средств. Цели дозирования лекарств, способы и варианты введения, интервал введения.
Действие ЛС на организм в большей степени определяется их дозой.
Доза - количество вещества, введенное в организм за один прием; выражается в весовых, объемных или условных (биологических) единицах.
Виды доз:
а) разовая доза – количество вещества на один прием
б) суточная доза - количество препарата, назначаемое на сутки в один или несколько приемов
в) курсовая доза - общее количество препарата на курс лечения
г) терапевтические дозы - дозы, в которых препарат используют с лечебными или профилактическими целями (пороговые, или минимальные действующие, средние терапевтические и высшие терапевтические дозы).
д) токсические и смертельные дозы – дозы ЛВ, при которых они начинают оказывать выраженные токсические эффекты или вызывать смерть организма.
е) загрузочная (вводная) доза – кол-во вводимого ЛС, которое заполняет весь объем распределения организма в действующей (терапевтической) концентрации: ВД = (Css * Vd)/F
ж) поддерживающая доза – систематически вводимое количество ЛС, которое компенсирует потери ЛС с клиренсом: ПД = (Css * Cl * DT)/F
Единицы дозирования ЛС:
1) в граммах или долях грамма ЛС
2) количество ЛС в расчете на 1 кг массы тела (например, 1 мг/кг ) или на единицу поверхности тела (например, 1 мг/м 2 )
Цели дозирования ЛС:
1) определить количество ЛС, необходимое для того, чтобы вызвать нужный терапевтический эффект с определенной длительностью
2) избежать явлений интоксикации и побочных эффектов при введении ЛС
Способы введения ЛС : 1) энтерально 2) парентерально (см. в. 5)
Варианты введения ЛС :
а) непрерывный (путем длительных внутрисосудистых инфузий ЛС капельно или через автоматические дозаторы). При непрерывном введении ЛС его концентрация в организме изменяется плавно и не подвергается значительным колебаниям
б) прерывистое введение (инъекционным или неинъекционным способами) - введение лекарства через определенные промежутки времени (интервалы дозирования). При прерывистом введении ЛС его концентрация в организме непрерывно колеблется. После приема определенной дозы она вначале повышается, а затем постепенно снижается, достигая минимальных значений перед очередным введением лекарства. Колебания концентрации тем значительнее, чем больше вводимая доза лекарства и интервал между введениями.
Интервал введения – интервал между вводимыми дозами, обеспечивающий поддержание терапевтической концентрации вещества в крови.
15. Введение лекарств с постоянной скоростью. Кинетика концентрации препарата в крови. Стационарная концентрация препарата в крови (C ss), время ее достижения, расчет и управление ею.
 Особенность введения ЛС с постоянной скоростью - плавное изменение его концентрации в крови при введении, при этом:
Особенность введения ЛС с постоянной скоростью - плавное изменение его концентрации в крови при введении, при этом:
1) время достижения стационарной концентрации лекарства составляет 4-5t ½ и не зависит от скорости инфузии (величины вводимой дозы)
2) при увеличении скорости инфузии (вводимой дозы) величина С SS также увеличивается в пропорциональное число раз
3) элиминация лекарства из организма после прекращения инфузии занимает 4-5t ½ .
Сss – равновесная стационарная концентрация – концентрация ЛС, достигаемая при скорости введения равной скорости выведения, поэтому:
![]() (из определения клиренса)
(из определения клиренса)
За каждый последующий период полувыведения концентрация ЛС прирастает на половину от оставшейся концентрации. Все ЛС, подчиняющиеся закону элиминации первого порядка, будут достигать Css через 4-5 периодов полувыведения.
Подходы к управлению уровнем Сss : изменить вводимую дозу ЛС или интервал введения
16. Прерывистое введение лекарств. Кинетика концентрации препарата в крови, терапевтический и токсический диапазон концентраций. Расчет стационарной концентрации (C ss), границ ее колебаний и управление ею. Адекватный интервал введения дискретных доз.
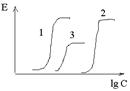
 Колебания концентрации ЛС в плазме крови: 1 - при постоянном внутривенном капельном введении; 2 -при дробном введении той же суточной дозы с интервалом 8 ч;3 - при введении суточной дозы с интервалом 24 ч.
Колебания концентрации ЛС в плазме крови: 1 - при постоянном внутривенном капельном введении; 2 -при дробном введении той же суточной дозы с интервалом 8 ч;3 - при введении суточной дозы с интервалом 24 ч.
Прерывистое введение ЛС – введение определенного количества ЛС через некоторые промежутки времени.
Равновесная стационарная концентрация достигается через 4-5 периодов полуэлиминации, время ее достижения не зависит от дозы (в начале, когда уровень концентрации ЛС невысок, скорость его элиминации также невысока; по мере увеличения количества вещества в организме нарастает и скорость его элиминации, поэтому рано или поздно наступит такой момент, когда возросшая скорость элиминации уравновесит вводимую дозу ЛС и дальнейший рост концентрации прекратиться)
Css прямо пропорциональна дозе ЛС и обратно пропорциональна интервалу введения и клиренсу ЛС.
Границы колебаний Css: ![]() ; C ss min = C ss max × (1 – эл. фр.). Колебания концентрации ЛС пропорциональны T/t 1/2 .
; C ss min = C ss max × (1 – эл. фр.). Колебания концентрации ЛС пропорциональны T/t 1/2 .
Терапевтический диапазон (коридор безопасности, терапевтическое окно) – это интервал концентраций от минимальной терапевтической до вызывающей появление первых признаков побочных действий.
Токсический диапазон – интервал концентрации от высшей терапевтической до смертельной.
Адекватный режим введения дискретных доз : такой режим введения, при котором флюктуация концентрации препарата в крови укладывается в терапевтический диапазон. Для определения адекватного режима введения ЛС необходимо рассчитать. Разница между Css max и Css min при этом не должна превысить 2Css.
Управление колебаниями Css:
Размах колебаний Css прямо пропорционален дозе ЛС и обратно пропорционален интервалу его введения.
1. Изменить дозу ЛС : при увеличении дозы ЛС диапазон колебаний его Css пропорционально увеличивается
2. Изменить интервал введения ЛС : при увеличении интервала введения ЛС диапазон колебаний его Css пропорционально уменьшается
Одновременно изменить дозу и интервал введения
Вводная (загрузочная) доза. Терапевтический смысл, расчет по фармакокинетическим параметрам, условия и ограничения ее использования.
Вводная (загрузочная) доза – доза, вводимая за один прием и заполняющая весь объем распределения в действующей терапевтической концентрации. ВД=(Css*Vd)/F ; =мг/л, =л/кг
Терапевтический смысл : вводная доза быстро обеспечивает действующую терапевтическую концентрацию ЛС в крови, что позволяет, например, быстро купировать приступ БА, аритмии и т.д.
Вводная доза может быть введена за один раз лишь тогда, когда игнорируется процесс распределения вещества
Ограничение использования ВД : если распределение ЛС происходит значительно медленнее, чем его поступление в кровь , введение сразу всей загрузочной дозы (особенно внутривенно) создаст концентрацию значительно выше терапевтической и обусловит возникновение токсических эффектов. Условие использования ВД : поэтому введение нагрузочных доз всегда должно быть медленным или дробным .
Поддерживающие дозы, их терапевтический смысл и расчет для оптимального режима дозирования.
Терапевтический смысл: ПД компенсирует потери с клиренсом за интервал между введениями препарата. Расчет для оптимального дозирования ЛС (для быстрого купирования приступа): … 1. Рассчитываем ВД: ВД=(Css*Vd)/FИндивидуальные, возрастные и половые различия фармакокинетики лекарств. Поправки для расчета индивидуальных значений объема распределения лекарств.
2. Половые различия в действии лекарств. Для женщин характерна меньшая масса тела, чем для мужчин, поэтому и величина доз лекарства для них должна… 3. Патологические состояния организма и действие лекарств а) заболевания печени: F ЛС из-за выключения пресистемного метаболизма, фракция несвязанного ЛС из-за недостатка…Почечный клиренс лекарств, механизмы, их количественные и качественные характеристики.
Механизмы почечного клиренса и их характеристика: 1. Фильтрация: ЛС, выделяемоетолько фильтрацией {инсулин} будет иметь клиренс,… Определяется: почечным кровотоком, несвязанной фракцией ЛС и фильтрационной способностью почек.Факторы, влияющие на почечный клиренс лекарств. Зависимость клиренса от физико-химических свойств лекарственных средств.
а) гломерулярная фильтрация б) скорость почечного кровотока в) максимальная скорость секрецииПеченочный клиренс лекарств, его детерминанты и ограничения. Энтерогепатический цикл лекарственных средств.
1) метаболизм (биотрансформация) путем окисления, восстановления, алкилирования, гидролиза, коньюгации и т.д. Основная стратегия метаболизма ксенобиотиков: неполярные вещества ® полярные… 2) секреция (выведение нетрансформированных веществ в желчь)Коррекция лекарственной терапии при поражении печени и других патологических состояниях.
Коррекцию режима дозирования при заболевании почек см. выше в в.26, общие принципы коррекции – в.25. Коррекция режима дозирования под контролем общего клиренса препарата: Коррекция дозы: Динд.=Дтипичн.×Clинд./Clтипичн.Коррекция режима дозирования под контролем остаточной функции почек.
Нам известно: а) остаточная функция почек, определяющаяся клиренсом креатинина у данного… б) общий клиренс данного ЛС (СlЛС/общий) и доля почечного клиренса ЛС в общем клиренсеСтратегия индивидуальной лекарственной терапии.
Признание важной роли концентрации как связующего звена фармакокинетики и фармакодинамики способствует созданию стратегии целевой концентрации - оптимизации дозы у данного больного на основе измерения концентрации ЛС. Она складывается из следующих этапов:
1. Выбор целевой концентрации
2. Расчет V d и Cl на основе типовых значений и внесения поправок с учетом таких факторов как масса тела и функция почек.
3. Ввод загрузочной дозы или поддерживающей дозы, рассчитанных с учетом значений TC, V d и Cl.
4. Регистрация реакции больного и определение концентрации ЛС
5. Пересмотр V d и Cl на основе результатов измерения концентрации.
6. Повтор шагов 3-6 с целью подбора необходимой для оптимальной реакции на лекарство поддерживающей дозы.
Биотрансформация лекарственных средств, ее биологический смысл, основная направленность и влияние на активность лекарств. Основные фазы метаболических превращений лекарств в организме.
Биотрансформация ЛС – химические превращения ЛС в организме.
Биологический смысл биотрансформации ЛС: создание субстрата, удобного для последующей утилизации (в качестве энергетического или пластического материала) или в ускорении выведения ЛС из организма.
Основная направленность метаболических превращений ЛС: неполярные ЛС → полярные (гидрофильные) метаболиты, выводимые с мочой.
Выделяют две фазы метаболических реакций ЛС:
1) метаболическая трансформация (несинтетические реакции, фаза 1) - превращение веществ за счет микросомального и внемикросомального окисления, восстановления и гидролиза
2) конъюгация (синтетические реакции, фаза 2) - биосинтетический процесс, сопровождающийся присоединением к лекарственному веществу или его метаболитам ряда химических группировок или молекул эндогенных соединений путем а) образования глюкуронидов б) эфиров глицерина в) сульфоэфиров г) ацетилирования д) метилирования
Влияние биотрансформации на фармакологическую активность ЛС:
1) чаще всего метаболиты биотрансформации не обладают фармакологической активностью или их активность снижена по сравнению с исходным веществом
2) в некоторых случаях метаболиты могут сохранять активность и даже превосходить по активности исходное вещество (кодеин метаболизируется до более фармакологически активного морфина)
3) иногда в ходе биотрансформации образуются токсичные вещества (метаболиты изониазида, лидокаина)
4) иногда в ходе биотрансформации образуются метаболиты с противоположными фармакологическими свойствами (метаболиты неселективных агонистов b 2 - адренорецепторов обладают свойствами блокаторов этих рецепторов)
5) ряд веществ является пролекарствами, которые исходно не дают фармакологических эффектов, но в ходе биотрансформации преобразуются в БАВ (неактивная L-допа, проникая через ГЭБ, превращается в мозге в активный дофамин, при этом нет системных эффектов дофамина).
Клиническое значение биотрансформации лекарств. Факторы,влияющие на их бтотрансформацию. Метаболическое взаимодействие лекарств.
Влияние на биотрансформацию ЛС различных факторов: а) функциональное состояние печени: при ее заболеваниях клиренс ЛС обычно… б) влияние факторов среды: курение способствует индукции цитохрома P450, в результате чего ускоряется метаболизм ЛС в…Пути и механизмы выведения лекарств из организма. Возможности управления выведением лекарств.
Пути и механизмы выведения ЛС: элиминация ЛС печенью и почками и некоторыми другими органами:
а) почками путем фильтрации, секреции, реабсорбции
б) печенью путем биотрансформации, экскреции с желчью
в) через легкие, слюну, пот, молоко и т.д. путем секреции, испарения
Возможности управления процессами выведения ЛС:
1. управление pH: в щелочной моче повышается выведение кислых соединений, в кислой – выведение основных соединений
2. применение желчегонных препаратов (холензим, аллохол)
3. гемодиализ, перитонеальный диализ, гемосорбция, лимфосорбция
4. форсированный диурез (в/в NaCl или глюкоза для водной нагрузки + фуросемид или маннитол)
5. промывание желудка, применение клизм
Концепция рецепторов в фармакологии, молекулярная природа рецепторов, сигнальные механизмы действия лекарств (типы трансмембранной сигнализации и вторичные посредники).
Рецепторы – молекулярные компоненты клетки или организма, которые взаимодействуют с ЛС и индуцируют ряд биохимических событий, ведущих к развитию фармакологического эффекта.
Концепция рецепторов в фармакологии:
1. Рецепторы детерминируют количественные закономерности действия ЛС
2. Рецепторы ответственны за селективность действия ЛС
3. Рецепторы посредники действия фармакологических антагонистов
Концепция рецепторов - основа целенаправленного применения лекарственных средств, влияющих на регуляторные, биохимические процессы и коммуникации.
Молекулярная природа рецепторов:
1. регуляторные белки, посредники действия различных химических сигналов: нейромедиаторов, гормонов, аутокоидов
2. ферменты и трансмембранные белки переносчики (Na + , K + АТФаза)
3. структурные белки (тубулин, белки цитоскелета, клеточная поверхность)
4. ядерные белки и нуклеиновые кислоты
Сигнальные механизмы действия лекарств:
1) проникновение растворимых в липидах лигандов через мембрану и их действие на внутриклеточные рецепторы.
2) сигнальная молекула связывается с внеклеточным доменом трансмембранного белка и активирует ферментативную активность его цитоплазматического домена.
3) сигнальная молекула связывается с ионным каналом и регулирует его открытие.
4) сигнальная молекула связывается с рецептором на поверхности клетки, который сопряжен с эффекторным ферментом посредством G-белка. G-белок активирует вторичный посредник.
Типы трансмембранной сигнализации:
а) через 1-TMS-рецепторы, обладающие и не обладающие тирозинкиназной активностью
б) через 7-ТMS-рецепторы, связанные с G-белком
в) через ионные каналы (лиганд-зависимые, потенциал-зависимые, щелевые контакты)
Вторичные посредники : цАМФ, ионы Ca2+, ДАГ, ИФ3.
Физико-химические и химические механизмы действия лекарственных веществ.
Основные фармакологические эффекты: 1) наркотическое 2) обще депрессивное 3) парализующее 4) местно раздражающее 5) мембранолитическое действия. Химическая природа веществ: химически инертные углеводороды, эфиры, спирты,… Механизм действия – обратимое деструирование мембран.Селективность и специфичность действия лекарств. Терапевтические, побочные и токсические эффекты лекарств, их природа с позиций концепции рецепторов. Терапевтическая стратегия борьбы с побочными и токсическими эффектами лекарств.
Специфичность –связывание ЛС со строго специфичным ему типом рецептора.
Селективность - способно связываться ЛС с одним или несколькими типами рецепторов более точно, чем с другими.
Более предпочтительно использовать термин селективность, т.к. маловероятно, что любая молекула ЛС может связаться только с одним типом рецепторных молекул, поскольку число потенциальных рецепторов у каждого пациента имеет астрономическое значение.
Терапевтическое действие - основной желательный фармакологический эффект, ожидаемый от данного фармакологического препарата.
Побочные эффекты – те эффекты, которые возникают при применении веществ в терапевтических дозах и составляют спектр их фармакологического действия.
Токсические эффекты – нежелательные эффекты, проявляющиеся у данного ЛС при выходе из терапевтического диапазона.
Связи терапевтического и токсического эффектов ЛС на основе анализа рецепторно-эффекторных механизмов:
1) терапевтический и токсический эффекты, опосредуемые одним и тем же рецепторно-эффекторным механизмом {празозин действует как альфа-селективный антагонист на рецепторы ГМК сосудов и оказывает гипотензивное действие при эссенциальной гипертензии, но при его большой дозе у больного может возникнуть постуральная гипотензия}
2) терапевтический и токсический эффекты, опосредуемые идентичными рецепторами, но различными тканями или различными эффекторными путями {сердечные гликозиды используют для увеличения сократительной способности миокарда, в тоже время они нарушают функцию ЖКТ, зрения за счет блокады Na + /K + -АТФазы клеточной мембраны}
3) терапевтический и токсический эффекты, опосредуемый различными типами рецепторов {например, норадреналин оказывает гипертензивное действие через a 1 -Ар, но при этом вызывает тахикардию через b 1 -Ар}
Терапевтическая стратегия борьбы с терапевтическими и побочными эффектами ЛС:
1. ЛС всегда следует вводить в наименьшей дозе, которая вызывает приемлемый терапевтический эффект
2. Снижение дозы одного ЛС за счет назначения другого ЛС со сходным действием, но через иные рецепторы и с иным профилем токсичности.
3. Селективность действия ЛС может быть увеличена путем управления концентрацией ЛС в районе рецепторов различных отделов организма (местное применение ЛС – ингаляционное применение сальбутамола при бронхиальной астме)
32. Термины и понятия количественной фармакологии: эффект, эффективность, активность, агонист (полный, частичный), антагонист. Клиническое различие понятий активность и эффективность лекарств.
 Эффект (ответ)
– количественный выход реакции взаимодействия клетки, органа, системы или организма с фармакологическим агентом.
Эффект (ответ)
– количественный выход реакции взаимодействия клетки, органа, системы или организма с фармакологическим агентом.
Эффективность – мера реакции по оси эффекта – величина отклика биологической системы на фармакологическое воздействие; это способность ЛС оказывать максимально возможное для него действие . Т.е. фактически это максимальная величина эффекта, которую можно достигнуть при введении данного лекарства. Численно характеризуется величиной Е max . Чем выше Е max , тем выше эффективность лекарства
Активность – мера чувствительности к ЛС по оси концентраций, характеризует аффинность (сродство лиганда к рецептору), показывает, какая доза (концентрация) ЛС способна вызвать развитие стандартного эффекта, равного 50% от максимально возможного для этого лекарства . Численно характеризуется величиной ЕС 50 или ED 50 . Чем выше активность ЛС, тем меньшая его доза требуется для воспроизведения терапевтического эффекта.
Эффективность: 1=2>3
Активность: 1>3>2
В клинической деятельности важнее знать эффективность, а не активность, т.к. нас больше интересует способность ЛС вызывать определенное действие в организме.
Агонист – лиганд, который связывается с рецептором и вызывает биологическую реакция, срабатывание физиологической системы. Полный агонист – максимальный отклик, частичный – вызывают меньшую реакцию даже при оккупации всех рецепторов.
 Антагонист
- лиганды занимающие рецепторы или изменяющие их таким образом, что они утрачивают способность взаимодействовать с другими лигандами, но сами не вызывающие биологической реакции (блокируют действие агонистов).
Антагонист
- лиганды занимающие рецепторы или изменяющие их таким образом, что они утрачивают способность взаимодействовать с другими лигандами, но сами не вызывающие биологической реакции (блокируют действие агонистов).
Конкурентные антагонисты - взаимодействуют с рецепторами обратимо и тем самым конкурируют с агонистами. Увеличение концентрации агониста может полностью устранить эффект антагониста. Конкурентный антагонист сдвигает кривую «доза-эффект» для агониста, увеличивает EC 50 , не влияет на E max .
Неконкурентные антагонисты - необратимо изменяют сродство рецепторов к агонисту, связывание часто происходит не с активным участком рецептора, увеличение концентрации агониста не устраняет действие антагониста. Неконкурентный антагонист снижает Emax, не изменяет EC50, кривая «доза-эффект» сжимается относительно вертикальной оси.
33. Количественные закономерности действия лекарств. Закон уменьшения отклика биологических систем. Модель Кларка и ее следствия. Общий вид зависимости концентрация – эффект в нормальных и логнормальных координатах.
Модель Кларка-Ариенса:
1. Взаимодействие между лигандом (L) и рецептором (R) обратимы.
2. Все рецепторы для данного лиганда – эквивалентны и независимы (их насыщение не влияет на другие рецепторы).
3. Эффект прямо пропорционален числу занятых рецепторов.
4. Лиганд существует в двух состояниях: свободном и связанном с рецептором.
А) , где Kd – константа равновесия, Ke – внутренняя активность.
Б) Т.к. при возрастании количества лигандов в какой-то момент времени все рецепторы окажутся заняты, то максимально возможное количество образованных комплексов лиганд-рецептор описывается формулой:
= [R] × (1)
Эффект определяется вероятностью активации рецептора при связывании с лигандом, т.е. его внутренней активностью (Ке), поэтому E = Ke×. При этом эффект максимален при Ке=1 и минимален и Ке=0. Естественно, что максимальный эффект описывается соотношением Emax = Ke×, где – общее число рецепторов для данного лиганда
Эффект зависит и от концентрации лиганда на рецепторах [С], поэтому
Из приведенных соотношений вытекает, что EC 50 =Kd
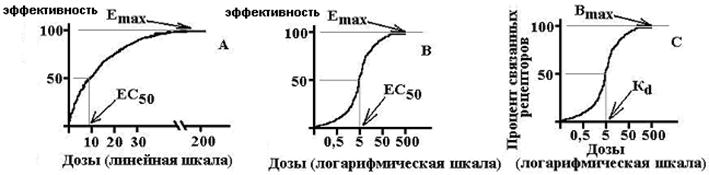
E max – максимальный эффект, B max – максимальное число связанных рецепторов, EC 50 – концентрация ЛС, при которой возникает эффект, равный половине от максимального, K d – константа диссоциации вещества от рецептора, при которой связано 50% рецепторов.
Закону убывания отклика соответствует параболическая зависимость «концентрация – эффективность». Ответ на малые дозы ЛС обычно возрастает прямо пропорционально дозе . Однако при увеличении дозы прирост ответной реакции снижается и в конечном счете может быть достигнута доза, при которой не происходит дальнейшего увеличения ответа (за счет оккупации всех рецепторов для данного лиганда).
Градуальная и квантовая оценка эффекта, сущность и клинические приложения. Количественная оценка активности и эффективности лекарств в экспериментальной и клинической практике.
Все фармакологические эффекты можно условно разделить на две категории:
а) градуальные (непрерывные, интегральные) эффекты – такие эффекты ЛС, которые могут быть измерены количественно (действие гипотензивных ЛС – по уровню АД). Описываются градуальной «кривой доза-эффект» (см. в. 33), на основе которой можно оценить: 1) индивидуальную чувствительность к ЛС; 2) активность ЛС; 3) максимальную эффективность ЛС.
б) квантовые эффекты – такие эффекты ЛС, которые являются дискретной величиной, качественным признаком, т.е. описываются всего лишь несколькими вариантами состояний (головная боль после приема анальгетика или есть, или нет). Описывается квантовой кривой доза-эффект, где отмечают зависимость проявления эффекта в популяции от величины принимаемой дозы ЛС. График зависимости доза-эффект при этом имеет куполообразный вид и идентичен Гауссовой кривой нормального распределения. На основе квантовой кривой можно: 1) оценить популяционную чувствительность ЛС; 2) отметить наличие эффекта при данной дозе; 3) выбрать среднюю терапевтическую дозу.
Различия между градуальной и квантовой характеристикой «доза-эффект»:
Количественная оценка активности и эффективности ЛС проводится на основе построения кривых «доза-эффект» и их последующей оценке (см. в.32)
Виды действия лекарственных средств. Изменение действия лекарств при их повторном применении.
1. По локализации: · местное – действие, возникающее на месте приложения ЛС (обычно кожа и… · резорбтивное – это действие, которое ЛС оказывает, когда всасывается в кровоток или непосредственно вводится в…Зависимость действия лекарств от возраста, пола и индивидуальных способностей организма. Значение суточных ритмов.
· дети – область фармакологии, занимающаяся изучением особенностей действия ЛС на детский организм, называется педиатрическая фармакология.… · пожилые люди – в пожилом и старческом возрасте фармакокинетические… 2. Пол – эксперименты на животных и клинические наблюдения свидетельствуют, что существуют половые различия в…Вариабельность и изменчивость действия лекарств. Гипо- и гиперреактивность, толерантность и тахифилаксия, гиперчувствительность и идиосинкразия. Причины вариабельности действия лекарств и рациональная стратегия терапии.
Вариабельность действия ЛС – отражает различие фармакологических эффектов одного ЛС у разных индивидуумов.
Изменчивость действия ЛС – отражает способность ЛС оказывать действие, которое отличается от его типичных фармакологических эффектов.
Варианты вариабельности и изменчивости действия ЛС:
1. Гипореактивность – снижение эффекта данной дозы ЛС по сравнению с тем эффектом, который наблюдается у большинства больных.
2. Гиперреактивность - повышение эффекта данной дозы ЛС по сравнению с тем эффектом, который наблюдается у большинства больных.
3. Толерантность - снижение ответной реакции организма на повторные введения ЛС; для того, чтобы восстановить реакцию на ЛС, его приходится вводить во все бóльших и бóльших дозах.
4. Тахифилаксия – состояние, при котором частое введение ЛС вызывает развитие толерантности уже через несколько часов, но при достаточно редких введения ЛС его эффект сохраняется в полной мере. Развитие тахифилаксии обычно связано с истощением эффекторных систем.
5. Гиперчувствительность – развитие аллергической или другой иммунной реакции на повторное введение ЛС.
6. Идиосинкразия – извращенная реакция организма на ЛС, связанное с генетическими особенностями метаболизма ЛС или индивидуальной иммунологической реактивностью.
Основные причины вариабельности действия ЛС:
1) изменение концентрации вещества в зоне рецептора – из-за различий в скорости всасывания, его распределения, метаболизма, элиминации
2) вариации в концентрации эндогенного лиганда - рецептора – пропранолол (β-адреноблокатор) замедляет ЧСС у людей с повышенным уровнем катехоламинов в крови, но не влияет на фоновую ЧСС у спортсменов.
3) изменение плотности или функции рецепторов.
4) изменение компонентов реакции, расположенных дистальнее рецептора.
Рациональная стратегия терапии: состоит в том, что для назначения ЛС и для того, чтобы оно оказало ожидаемый эффект, необходимо учитывать индивидуальные факторы организма (возраст, пол и др.), суточные ритмы человека, наличие у него хронических заболеваний и других отклонений. Также необходимо прогнозировать развитие нехарактерных эффектов, учитывая все возможные варианты изменчивости действия ЛС.
Оценка безопасности лекарств. Терапевтический индекс и стандартные границы безопасности.
На создание и внедрение нового ЛС затрачиваются огромные средства – от 100 до 350 млн долларов и более. Эти расходы включают труд, затраченный на… Для того, чтобы пройти все этапы оценки ЛС должно соответствовать основному… Оценка безопасности новых ЛС проводится в 2 этапа:Фармакокинетическое взаимодействия лекарственных средств (примеры).
Фармакокинетическое взаимодействие ЛС является разновидностью фармакологического взаимодействия, т.е. взаимодействие лекарств, которое проявляется только при их совместном поступлении в организм человека.
Фармакокинетическое взаимодействие осуществляется на этапе всасывания, распределения и депонирования, метаболизма и выведения.
1. На этапе всасывания – этот вид взаимодействия может приводить к увеличению или уменьшению их всасывания. Его можно избежать, если делать интервал между приемами ЛС не менее 4 часов.
При введении препарата per os его всасывание детерминируют:
· рН среды – неионизированные ЛС всасываются в ЖКТ лучше ионизированных, поэтому повышение рН желудочного сока повышает всасывание слабых оснований и снижает всасывание слабых кислот. Пример: антациды, блокаторы Н 2 -гистаминовых рецепторов тормозят всасывание кетоконазола и др. противогрибковых препаратов, непрямых антикоагулянтов, ацетилсалициловой кислоты, барбитуратов (почти полностью предотвращают их снотворное действие); повышение рН среды улучшает всасывание глибутида, ускоряет растворение оболочки кишечно-растворимых веществ.
· прямое взаимодействие в ЖКТ – образование хелатных комплексов и соединений, не всасывающихся в ЖКТ. Примеры: активированный уголь образует нерастворимые соединения с ЛС, предотвращая их всасывание при отравлении; тетрациклины взаимодействуют с кальцием, аллюминием, железом, магнием с образованием хелатных комплексов, поэтому их всасывание снижается при применении антацидов, препаратов висмута; фторхинолоны + антациды или сукралфат = снижение эффективности антибактериальной терапии.
· моторика ЖКТ – может вызывать либо ускорение, либо замедление всасывания ЛС. Примеры: прокинетики (метоклопромид) ускоряют всасывание быстро всасывающихся ЛС (этанол, парацетамол, тетрациклин) и замедляют у медленно всасывающихся (дигоксин, циметидин); слабительные средства снижают всасывание и биодоступность ЛС; при приеме антихолинергических ЛС, блокаторов Н 2 -гистаминовых рецепторов (удлинение времени прохождения ЛС по ЖКТ) повышается биодоступность и всасывание сердечных гликозидов, препаратов железа, что может привести в проявлению токсических эффектов.
· кишечная микрофлора – она принимает непосредственное участие во всасывании ЛС, поэтому любой дисбактериоз проявляется нарушениями всасывания ЛС. Примеры: дигоксин + эритромицин = повышение концентрации дигоксина в крови и развитие нежелательных эффектов; пероральные конрацептивы + АБ широкого спектра = снижение эффекта контрецепции
· повреждение СО кишечника – тормозит всасывание некоторых ЛС. Примеры: цитостатики (циклофосфамид) тормозят всасывание дигоксина; нарушение всасывания препаратов железа, цианокобаламина, фолиевой кислоты.
На этапе распределения и депонирования
· конкурентное вытеснение из связи с альбуминами плазмы крови – если ЛС связано с белками менее 90%, то вытеснение из связи с ним не приведет к… · вытеснение из связи с белками в тканях: хинидин вытесняет дигоксин +… 3. На этапе метаболизма – ЛС могут повышать либо снижать активность ферментных систем, участвующих в метаболизме ЛС (…На этапе выведения
· изменение канальцевой секреции – хинидин + дигоксин = повышение концентрации дигоксина в крови и развитие токсических эффектов (хинидин… · изменение канальцевой реабсорбции – реабсорбции подвергаются только… 40.Фармакодинамическое взаимодействие лекарственных веществ. Антагонизм, синергизм, их виды. Характер изменения…Побочные и токсические эффекты лекарственных веществ. Тератогенное, эмбритоксическое, мутагенное действие лекарств. Медицинские и социальные аспекты борьбы с лекарственной зависимостью, наркоманиями и алкоголизмом. Понятие о токсикоманиях.
Побочные эффекты – те эффекты, которые возникают при применении веществ в терапевтических дозах и составляют спектр их фармакологического действия, могут быть первичными и вторичными:
а) первичные побочные эффекты – как прямое следствие влияния данного препарата на определенный субстрат {гипосаливация при применении атропина для устранения брадиаритмии}
б) вторичные побочные эффекты – косвенно возникающие неблагоприятные влияния {АБ, подавляя нормальную микрофлору, могут привести к суперинфекции}
Токсические эффекты – нежелательные эффекты, проявляющиеся у данного ЛС при выходе из терапевтического диапазона {передозировка ЛС}
Избирательность действия ЛС зависит от его дозы. Чем выше доза препарата, тем менее избирательным он становится.
Тератогенное действие – способность ЛС при назначении его беременной женщине вызывать анатомические аномалии развития плода {талидомид: фокомелия, противобластомные ЛС: множественные дефекты}
Эмбриотоксическое действие – неблагоприятное воздействие, не связанное с нарушением органогенеза в первые три месяца беременности. На более поздних сроках проявляется фетотоксическое действие .
Мутагенное действие ЛС – повреждение зародышевой клетки и ее генетического аппарата ЛС, что проявляется изменением генотипа потомства {адреналин, цитостатики}.
Канцерогенное действие ЛС – способность некоторых ЛС индуцировать канцерогенез.
1) Лекарственная зависимость – состояние психики и/или физическое состояние, которое является следствием воздействия на организм ЛС и характеризуется специфическими поведенческими реакциями, трудно преодолимым стремлением повторно принимать ЛС, чтобы добиться особого психического эффекта или избежать дискомфорта при отсутствии ЛС в организме. Лекарственная зависимость характеризуется:
а) психологической зависимостью – развитием эмоционального дистресса при прекращении приема ЛС. Человек ощущает себя опустошенным, погружается в депрессию, испытывает чувство страха, тревоги, его поведение становится агрессивным. Все эти психопатологические симптомы возникают на фоне мыслей о необходимости ввести себе ЛС, вызвавшее зависимость. Стремление к приему ЛС может колебаться от простого желания до страстной жажды приема ЛС, которая поглощает все остальные потребности и превращается в смысл жизни человека. Считают, что психологическая зависимость развивается тогда, когда у человека появляется сознание того, что оптимального самочувствия он может достигнуть исключительно благодаря введению ЛС. Основа психологической зависимости - вера человека в действие лекарства (в литературе описаны случаи развития психологической зависимости к плацебо).
б) физической зависимостью - нарушением нормального физиологического состояния организма, которое требует постоянного присутствия в нем ЛС для поддержания состояния физиологического равновесия. Прекращение приема лекарства вызывает развитие специфического симптомокомплекса - абстинентного синдрома – комплекса психических и нейровегетативных расстройств в виде нарушения функции в сторону, противоположную той, которая характерна для действия {морфин устраняет боль, угнетает дыхательный центр, суживает зрачки, вызывает запор; при абстиненции у пациента возникают мучительные боли, частое шумное дыхание, зрачки расширены и развивается упорная диарея}
в) толерантностью . Толерантность к средствам, вызывающим лекарственную зависимость зачастую носит перекрестный характер, т.е. возникает не только к данному химическому соединению, но и ко всем структурно подобным соединениям. Например, у пациентов с лекарственной зависимостью к морфину толерантность возникает не только к нему, но и к другим опиоидным анальгетикам.
Для развития лекарственной зависимости наличие всех 3 критериев не является необходимым условием.
Опиоиды, барбитураты, алкоголь вызывают сильные физическую, психологическую зависимости и толерантность. Анксиолитики (диазепам, альпразолам) преимущественно вызывают психологическую зависимость.
2) Наркомания (наркотическая зависимость) – это крайне тяжелая форма лекарственной зависимости, компульсивное применение ЛС, характеризующееся все возрастающим, непреодолимым влечением к введению данного лекарства все увеличивая его дозы. Компульсивность влечения означает, что потребность во введении лекарства доминирует у пациента над всеми другими (даже витальными) потребностями. С позиций данного определения, влечение к морфину – наркомания, тогда как влечение к никотину – лекарственная зависимость.
3) Пристрастие к лекарству - характеризует менее интенсивное влечение к приему лекарств, когда отказ от лекарства вызывает только ощущение легкого дискомфорта, без развития физической зависимости или развернутой картины психологической зависимости. Т.о. пристрастие охватывает ту часть лекарственной зависимости, которая не подпадает под определение наркомании. Например, упомянутая выше лекарственная зависимость к никотину – форма пристрастия.
4) Злоупотребление лекарственными средствами – самовольное применение лекарственных средств в таких дозах и такими способами, которые отличаются от принятых медицинских или социальных стандартов в данной культуре и в данное время. Т.о. злоупотребление ЛС охватывает только социальные аспекты применения лекарств. Примером злоупотребления является использование анаболических стероидов в спорте или для улучшения телосложения молодыми мужчинами.
5) Алкоголизм – хроническое злоупотребление алкоголя (этилового спирта), приводящее со временен к поражению ряда органов (печени, ЖКТ, ЦНС, сердечно-сосудистой системы, иммунной системы) и сопровождающееся психико-физической зависимостью.
6) Токсикомания – хроническое злоупотребление различными ЛС (в т.ч. наркотиками, алкоголем, галлюциногенами), проявляющееся многообразными психическими и соматическими расстройствами, нарушением поведения, социальной деградацией.
Лечение лекарственной зависимости трудная и неблагодарная задача. До сих пор не создано эффективной методики, которая бы обеспечивала бы успех лечения более чем у 30-40% пациентов. Достижение сколько-нибудь заметных результатов возможно только при полной кооперации усилий пациента, врача и того социального окружения, в котором находится заболевший (принцип добровольности и индивидуальности). В основе современных методик лежат следующие принципы:
Психотерапевтические и трудотерапевтические методы;
Групповое лечение и реабилитация (общества анонимных алкоголиков, наркоманов)
Постепенная или резкая отмена препарата на фоне детоксикационной терапии
Проведение заместительной терапии (замена наркотического средства медленно и длительнодействующими аналогами с их последующей отменой; например, т.н. программа метадоновой заместительной терапии у героиновых наркоманов)
Лечение специфическими антагонистами (налоксоном и налтрексоном) или сенсибилизирующими средствами (тетурамом)
Нейрохирургический методы криодеструкции поясной извилины и гиппокампа
42.Фармацевтическое взаимодействие лекарственных средств. Предупреждения и меры предосторожности при проведении инфузионной терапии.
Фармацевтическое взаимодействие - вид взаимодействия, связанный с физико-химической реакцией между ЛС в процессе изготовления лекарственного препарата, еще до введения этих средств в организм человека
а) типичные ошибки, приводящие к фармацевтической несовместимости: выписывание сложных рецептов, неправильное хранение, не учитывается возможность адсорбции ЛС на поверхности пластмассы {органические нитраты}
б) проблемы при инфузионной терапии: смешивание растворимых солей, производных нерастворимых слабых кислот или оснований приводит к их преципитации; в жидких лекарственных формах гидролизуются сердечные гликозиды и алкалоиды, разрушаются АБ; рН среды (в щелочной среде выпадают в осадок алкалоиды)
в) рекомендации: 1) Все смеси лучше готовить ex tempore 2) Наиболее надежен раствор с одним ЛС 3) Все растворы перед употреблением необходимо проверить на наличие взвесей 4) Взаимодействие может происходить без видимых изменений растворов 5) Нельзя добавлять ЛС в кровь и растворы АК 6) При отсутствии специальных указаний препараты следует растворять в 5%-ом р-ре глюкозы (рН 3,5-6,5), изотоническом растворе NaCl (рН 4,5-7,0).
Раствор глюкозы, стабилизированный HCl, несовместим с адреналином, бензилпенициллином, апоморфином, канамицином, витамином С, олеандомицином, сердечными гликозидами. Сердечные гликозиды несовместимы с атропином, папаверином, платифиллином. АБ несовместимы с гепарином, гидрокортизоном. Витамины группы В несовместимы между собой, с витаминами PP, С. Витамин РР и С также между собой несовместимы.
Нельзя смешивать ни с какими другими препаратами: фенотиазид, хлорпромазин, барбитураты, препараты витамина С, амфотерицин В, фуросемид, сульфадиазин, аминофиллин, адреномиметики.
Виды фармакотерапии. Деонтологические проблемы фармакотерапии.
1. этиотропная ФТ – коррекция и устранение причины заболевания {АБ при инфекционных заболеваниях} 2. патогенетическая ФТ – воздействие на механизм развития болезни {ингибиторы… 3. симптоматическая ФТ – устранение симптомов заболевания при невозможности влияния на его причину или патогенез {НПВС…Основные принципы лечения и профилактика отравлений лекарственными веществами. Антидотная терапия(примеры).
Классификация отравляющих веществ (ОВ):
1. По принадлежности к определенным классам химических соединений: барбитураты, бензодиазепины, цианиды.
2. По происхождению: небиологической природы (кислоты, щелочи, соли тяжелых металлов), токсические продукты жизнедеятельности некоторых МБ (ботулотоксин), растительного происхождения (алколоиды, гликозиды), животного происхождения (яды змей, пчел)
3. По степени токсичности: а) чрезвычайно токсические (DL50 < 1 мг/кг) б) высоко токсические (1-50) в) сильно токсические (50-500) г) умеренно токсические (500-5000) д) мало токсические (5000-15000) е) практически нетоксические (> 15.000)
4. По токсикологическому действию: а) нервно-паралитического (бронхоспазм, удушье) б) кожно-резорбтивные в) общетоксические (гипоксические судороги, кома, параличи) г) удушающие д) слезоточивые и раздражающие е) психотропные (нарушение психической активности, сознания)
5. В зависимости от сферы преимущественного использования: промышленные яды, ядохимикаты, бытовые яды, боевые отравляющие вещества, лекарственные вещества.
6. В зависимости от токсичности ЛС: список А – ЛС, назначение, применение, дозирование и хранение которых в связи с высокой токсичностью должны производиться с высокой осторожностью. К этому же списку относятся ЛС, вызывающие наркоманию; список В - ЛС, назначение, применение, дозирование и хранение которых должны производиться с предосторожностью в связи с возможными осложнениями при их применении без медицинского контроля.
Избирательно токсическое действие ЛС.
а) кардиотоксическое: сердечные гликозиды, препараты калия, антидепрессанты
б) нейротоксическое: психофармакологические средства, оксихинолины, аминогликозиды
в) гепатотоксические: тетрациклины, левомицетин, эритромицин, парацетамол
г) нефротоксическое: ванкомицин, аминогликозиды, сульфаниламиды
д) гастроентеротоксическое: стероидные противовоспалительные средства, НПВС, резерпин
е) гематотоксическое: цитостатики, левомицетин, сульфаниламиды, нитраты, нитриты
ж) пневмотоксические
Токсикокинетика – изучает всасывание, распределение, метаболизм и выведение ЛС, принятых в токсических дозах.
Поступление отравляющих веществ в организм возможно а) энтерально б) парентерально. Скорость и полнота всасывания отражает скорость развития токсического эффекта и его выраженность.
Распределение в организме: Vd=D/Cmax – действительный объем, в котором распределяется в организме отравляющее вещество. Vd > 5-10 л/кг – ОВ трудно допустимо для его удаления (антидепрессанты, фенотиазины). Vd < 1 л/кг – ОВ легче удалить из организма (теофиллин, салицилаты, фенобарбитал).
Передозировка – изменение фармакокинетических процессов: растворимости, связи с белками, метаболизма ® значительное повышение свободной фракции ЛС ® токсические эффект.
Кинетика первого порядка при увеличении концентрации ЛС переходит в кинетику нулевого порядка.
Токсигенная стадия – дезинтоксикационная терапия, соматогенная стадия – симптоматическая терапия.
Токсикодинамика . Основные механизмы токсического действия:
а) медиаторный: прямой (по типу конкурентной блокады – ФОС, психомиметики) и непрямой (активаторы или ингибиторы ферментов)
б) взаимодействие с биомолекулами и внутриклеточными структурами (гемолитические вещества)
в) метаболизм по типу летального синтеза (этиловый спирт, тиофос)
г) ферментный (яды змей и др.)
Виды действия: местное, рефлекторное, резорбтивное.
Классификация отравлений:
1. Этиопатогенетическая:
а) случайное (самолечение, ошибочный прием)
б) преднамеренное (с целью самоубийства, убийства, развития у пострадавшего беспомощного состояния)
2. Клиническая:
а) в зависимости от скорости развития отравления: острое (поступление однократно или с коротким интервалом времени токсической дозы вещества), подострое (замедленное развитие клинической картины после однократного приема), хроническое
б) в зависимости от проявления основного синдрома: поражение ССС, поражение ДС и др.
в) в зависимости от тяжести состояния больного: легкой, средней, тяжелой, крайне тяжелой
3. Нозологическая: учитывает название ЛС, название группы веществ
Общий механизм смерти при отравлении:
а) поражение ССС:
1) снижение АД, гиповолемия периферических сосудов, коллапс, бради- или тахикардия (трициклические антидепрессанты, бета-блокаторы, блокаторы кальциевых каналов)
2) аритмии (желудочковая тахикардия, фибрилляция – трициклические антидепрессанты, теофиллин, амфетамин)
б) поражение ЦНС: ступор, кома ® угнетение дыхания (наркотики, барбитураты, алкоголь, гипно-седативные ЛС)
в) судороги, мышечная гиперреактивность и ригидность ® гипертермия, миоглобинурия, почечная недостаточность, гиперкалиемия
Токсикологическая триада:
1) длительность применения, доза и вещество ® анамнез.
2) оценка состояния сознания по симптомам: дыхания, АД, температура тела
3) лабораторные данные
Основные принципы лечения:
I. Первая неотложная помощь : искусственное дыхание, массаж сердца, противошоковая терапия, контроль за водно-электролитным балансом
II. Задержка всасывания и удаление из организма не всосавшегося ОВ:
Цель: прекратить контакт с ОВ
1. Парентеральный путь:
а) через легкие:
1) прекратить ингаляцию
2) раздражающие вещества (нашатырный спирт, формальдегид) ® закрепить активные движения, согреть, дать кислород и пеногасители (у нашатырного спирта пеногаситель уксус, а у формальдегида – разбавленный раствор нашатырного спирта)
б) через кожу: смыть обильным количеством теплой воды с мылом или моющим средством, специфические противоядия, нейтрализация и прекращение воздействия ОВ на кожу (ФОС: обмывают водой, удаляют с помощью 10-15% нашатырного спирта или 5-6% раствора гидрокарбоната натрия с водой; фенолкрезол: растительное масло или этиленгликоль, но нельзя вазелиновое масло, KMNO 4: 0,5-1%-ый раствор аскорбиновой кислоты или равные объемы 3% перекиси водорода и 3% раствора уксусной кислоты, CCl 4 , скипидар, бензин: теплая мыльная вода)
в) при инъекции в конечность: жгут выше места инъекции
г) при попадании в глаза: промывание теплым физраствором или молоком в течении 10-20 минут, закапать местный анестетик; при попадании кислот и щелочей нельзя нейтрализовать. Обязательна консультация офтальмолога.
2. Энтеральный путь: освободить желудок от ОВ, ускорить пассаж
а) удаление ОВ:
1) предварительно прием воды. Нельзя принимать молоко (исключение – едкие отравляющие вещества) и этанол (исключение –метанол).
2) рвота – показана преимущественно при отравлении крупными таблетками или капсулами, которые не могут пройти через зонд. Можно спровоцировать рефлекторно или рвотными средствами (NaCl: 1 столовая ложка на 1 стакан воды; сироп ипекакуаны: взрослым 2 столовые ложки, детям 2 чайные ложки; горчица: 1-2 чайные ложки на стакан воды; апоморфин: 5-10 мг/кг подкожно, кроме детей до 5 лет). Нельзя вызывать рвоту после приема: органических растворителей – опасность ингаляций, моющих средств – пенообразование, судорожных ОВ – опасность аспирации, едких веществ – повреждение пищевода)
3) зондовое промывание желудка – является экстренным и обязательным мероприятием. Желудок промывают, если с момента отравления прошло не более 4-6 часов, иногда до 10 часов; при отравлении ацетилсалициловой кислотой – через 24 часа. Предварительно интубируют пациента трубкой с раздувной манжетой: в коматозном состоянии при отсутствии кашлевого и ларингеального рефлекса. Желудок промывают водой или физраствором 30° С, время процедуры 4 часа и более. В конце промывания – активированный уголь и сульфат натрия.
б) снижения всасывания из ЖКТ: активированный уголь внутрь после опорожнения желудка + сульфат натрия или магния. Особенности мероприятий по снижению всасываемости:
1) органические растворители: нельзя вызывать рвоту, промывание желудка после интубации, активированный уголь + вазелиновое масло
2) моющие средства: нельзя вызывать рвоту и промывать желудок, необходимо давать много воды + пеногасители (симетикон)
3) кислоты и щелочи: нельзя вызывать рвоту, промывание желудка через зонд, смазанный растительным маслом после введения наркотического анальгетика – единственное показание для дачи молока. При отравлении кислотами – антациды, при отравлении щелочи – лимонная или уксусная кислоты.
III. Удаление из организма всосавшегося ОВ
а) форсированный диурез (условия: достаточный почечный кровоток и клубочковая фильтрация; за 24 часа влить-вылить 20-25 литров)
б) перитонеальный гемодиализ
в) гемосорбция
г) обменное переливание крови
д) форсированная гипервентиляция
IV. Симптоматическая терапия функциональных нарушений.
2) токсикокинетические – ускоряют биотрансформацию ОВ (тримедоксима бромид, натрия тиосульфат, этанол, АО) 3) фармакологические – атропин, налоксон 4) иммунологические противоядияПравила выписывания ядовитых, наркотических и сильнодействующихсредств.
Рецепты на наркотические в-ва (морфин, омнопон, промедол, фенамин, кокаин и др.) и приравненные к ним независимо от лек. ф-мы выписывают на спец.… В случае, если лек. ср-во содерж. спирт, то ставится печать леч. учрежд. «Для… В тех случаях, когда макс. дозу ядовитых или сильнод. в-в превышают, необх. указать их кол-во прописью с добавлением…Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
Информация о времени всасывания, распределения и элиминации, то есть о фармагокинетике лекарственных веществ может быть выражена математически. Это необходимо при планировании режимов клинического применения лекарственных препаратов. На основании фармакокинетических данных разрабатываются принципы рационального выбора и дозирования последних. Вместе с тем, наряду с этими расчетами, требуется постоянный клинический контроль за действием препарата, так как фармакокинетические исследования лишь дополняют этот контроль и позволяют делать более объективные выводы.
Элиминация большинства лекраственных веществ происходит в соответствии с экспоненциальной кинетикой, а именно таким образом, что за каждый равный промежуток времени из организма исчезает постоянная часть от общего количества введенного лекарственного вещества. В большинстве случаев скорость изчезновения лекарственного вещества из организма отражается в соответствующей скорости снижения уровня препарата в плазме.
Концентрация препаратов в биологических жидкостях определяется методом жидкостной или газожидкостной хроматографии, радиоиммунного или ферментнохимического анализа, полярографически или спектрофотометрически. Повторное определение концентраций препарата в крови на протяжении курса лечения называется ТЕРАПЕВТИЧЕСКИМ МОНИТОРИНГОМ. Для этой цели иногда используют слюну, являющуюся безбелковым ультрафильтратом крови.
На основании полученных значений строится график, на оси абсцисс которого отмечается время отбора проб, а на оси ординат - концентрация лекарственного вещества в биологической пробе (наиболее часто - в плазме крови) в соответствующих единицах. Полученная кривая характеризует фармакокинетические процессы, происходящие с препаратом. Так, после однократного в/венного введения концентрация лекарственного вещества в плазме уменьшается экспоненциально. Скорость экспоненциального процесса может быть охарактеризована через константу скорости (К), отражающую изменение концентрации за единицу времени или через период полуэкспоненциального процесса (обозначаемого как Т 1/2 или t/2). Этот период равен времени, необходимому для завершения процесса на 50%.
О выведении лекарственных средств из организма можно судить по периоду полувыведения или периоду полуэлиминации, полужизни, полусуществования, который определяют как время снижения концентрации препарата в крови на 50% от введенного количества препарата или выведения 50% биодоступного количества препарата.
Термин "ПЕРИОД ПОЛУЭЛИМИНАЦИИ" более удачен, чем "ПЕРИОД ПОЛУВЫВЕДЕНИЯ", так как лекарства не только выводятся, но и биотрансформируются. Период полуэлиминации можно определить по графику "концентрациявремя", измерив интервал времени, за который любая концентрация вещества на кривой уменьшилась наполовину.
Практически важно помнить, что за один период полувыведения
из организма выводится 50% лекарственного средства, за два периода - 75%, за три периода - 90%, за четыре - 94%.
Поскольку для полной элиминации экспоненциального типа требуется время более длительное, чем четыре (4) периода полужизни, то при повторном введендии препарата через более короткие промежутки времени отмечается кумуляция (накопление) его. Подсчитано, что для того, чтобы достичь плато концентрации, то есть постоянной концентрации препарата в плазме, требуется около четырех периодов биологической полужизни препарата.
Важно, что снижение элиминации лекарственного средства приводит к удлинению биологического периода полужизни и пролонгированию действия препарата.
У некоторых же лекарственных средств фармакологическое действие может быть более длительным, чем можно предположить на основании их t/2. В связи с этим такие препараты, как гормон роста, анаприлин можно вводить с промежутками более длительными, чем их Т/2.
Чтобы избежать опасного повышения уровня препарата в плазме у больных со сниженной элиминацией при нарушении функции печени, почек или сердечно-сосудистой системы, следует снизить поддерживающие дозы его либо за счет уменьшения каждой дозы, либо за счет удлинения интервалов между введением пропорционально удлинению периода их биологической полужизни.
БИОЛОГИЧЕСКАЯ ДОСТУПНОСТЬ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Для оказания терапевтического эффекта лекарственное вещество должно быть доставлено в те органы или ткани, в которых осуществляется его специфическое действие (в биофазу). При внутрисосудистом введении лекарство сразу и полностью попадает в кровеносное русло. При других путях введения (перорально, в/м, п/к и т. д.) прежде чем попасть в кровоток, лекарственное вещество должно пройти ряд биологических мембран клеток (слизистой желудка, клеток печени, мышц и т. д.) и только тогда какая-то часть его попадет в системный кровоток. Эффект препарата во многом зависит от того, какая часть от введенной дозы лекарственного средства попадает в системный кровоток. Этот показатель характеризует биологическую доступность средства (F). Таким образом, посуществу, биодоступность лекарства отражает концентрацию его у рецепторов, то есть в крови и тканях организма после всасывания. Естественно, что биодоступность одного и того же средства будет разная у каждого больного. Очевидно, что при внутивенном введении лекарства биодоступность его равна приблизительно 100%, а при других путях введения биодоступность почти никогда не достигает 100%.
Различают АБСОЛЮТНУЮ И ОТНОСИТЕЛЬНУЮ БИОДОСТУПНОСТЬ. Абсолютная биодоступность - это доля поглощенного препарата при внесосудистом введении по отношению к его количеству после в/венного введения.
Важным показателем является ОТНОСИТЕЛЬНАЯ БИОДОСТУПНОСТЬ, которая определяет относительную степень всасывания лекарственного вещества из испытуемого препарата и из препаратов сравнения. Другими словами, относительная биодоступность определяется для различных серий препаратов, для лекарственных средств при измене
нии технологии производства, для препаратов, выпущенных различными производителями, для различных лекарственных форм. Для определения относительной биодоступности могут использоваться данные об уровне содержания лекарственного вещества в крови или же его экскреции с мочой после одноразового или многократного введения. Этот термин важен при сравнении 2-х препаратов между собой.
Сравнительная биодоступность одних и тех же препаратов, сделанных разными фирмами (пример: кокарбоксиназа польского поисхождения и сделанная в г. Днепропетровске), определяется путем сопоставления химической, биологической и терапевтической эквивалентностей.
ХИМИЧЕСКАЯ ЭКВИВАЛЕНТНОСТЬ - это совпадение у препаратов не только химической формулы лекарств, но и совпадение изомерии, пространственной конфигурации атомов в молекуле лекарственного вещества.
БИОЛОГИЧЕСКАЯ ЭКВИВАЛЕНТНОСТЬ означает одинаковоую, равную концентрацию действующего вещества в крови при приеме препарата разных фирм.
Наконец, ТЕРАПЕВТИЧЕСКАЯ ЭКВИВАЛЕНТНОСТЬ подразумевает одинаковый, равноценный терапевтический эффект.
Если перечисленные 3 характеристики совпадают, говорят, что лекарственные препараты обладают равной биодоступностью (биодоступны). В настоящее время имеется много примеров того, что аналогичные препараты биологически неэквивалентны вследствие различий в биодоступности. Практикующий врач должен помнить об этом, особенно при переводе больного с одного препарата на аналогичный препарат другой фирмы.
Безусловно, что на все эти вопросы может дать ответ только новая наука - а именно КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ. Это самостоятельная наука со своим предметом и задачами исследования. Почему она выделилась в самостоятельный предмет? Прежде всего потому, что, как оказалось, не все можно изучать в эксперименте на животных. Например, психические процессы, которые в высшей степени свойственны лишь человеку.
Бурное развитие фармацевтической промышленности привело к созданию огромного количества лекарственных средств. Появилась лавина препаратов, создавших своеобразные лекарственные джунгли. Сложившаяся ситуация весьма затрудняет выбор нужного средства даже в одной группе лекарственных препаратов, мешает врачу сориентироваться на оптимальное для конкретного больного средство. На все эти вопросы помогает ответить клиническая фармакология.
В качестве примера можно привести возможности выбора препарата при коллагенозах (болезни соединительной ткани, ревматоидный артрит, ревматизм, системная красная волчанка и т. д.). С одной
стороны - ацетилсалициловая кислота (аспирин), но вместе с тем, имеются другие современные ненаркотические анальгетики, обладающие, по сравнению с аспирином, рядом преимуществ: напроксен, пироксикам и т. д.
Что лучше, какой препарат данному больному будет более адекватен, какой дает наиболее выраженный терапевтический эффект? На эти вопросы и помогает ответить клиническая фармакология.
Основными задачами клинического фармаколога являются:
1) Выбор лекарственных средств для лечения конкретного боль
2) Определение наиболее подходящих для него лекарственных
форм и режима их применения.
3) Выбор пути введения препарата.
4) Мониторное наблюдение за действием препарата.
Для этой цели ставят датчики, дающие постоянную картину концентрации препарата в крови на мониторе. Изучаются все другие аспекты фармакокинетики.
5) Изучение нежелательных реакций и побочных эффектов на лекарства, их устранение, а также изучение последствий взаимодействия лекарств у данного больного.
6) Передача накопленных знаний путем обучения.
7) Организация лабораторных и информационных служб, а также консультации по планированию исследований (ВОЗ, 1971).
ФАРМАКОДИНАМИКА (ФД) - это раздел фармакологии, изучающий
1) механизмы действия (то есть сущность процессов взаимодействия с тканевыми, клеточными или субклеточными рецепторами - специфическими или неспецифическими)1.
1 02) фармакологические эффекты (то есть содержание и изменения вли яния препарата в зависимости от возраста, пола больного, характера и течения заболевания, сопутствующей патологии), а также 3) локализацию действия лекарств. Более коротко ФД можно определить как раздел фармакологии, изучающий действие лекарственных средств на организм.
Обычно механизм действия лекарственного средства изучается в экспериментах на животных, так как почти всегда они одинаковы у животных и человека. Знание механизма действия лекарственного средства позволяет врачу осмысленно выбрать необходимый препарат для лечения.
Механизмов действия лекарственных средств много, но все их условно можно свести в 2 группы.
Первая группа механизмов связана с теми случаями, когда лекарства действуют на специфицеские рецепторы, - то есть это РЕЦЕПТОРНЫЕ МЕХАНИЗМЫ.
Вторая группа механизмов связана с лекарствами, которые в силу своих физико-химических свойств действуют не через рецепторы. Здесь прежде всего можно указать действие лекарственных средств на специфические ферменты их физико-химическое воздействие на мембраны клеток и прямое химическое взаимодействие с веществами клеток.
В качестве примера нерецепторных механизмов можно привести
случай со средствами для наркоза, скажем с фторотаном. Он является отличным растворителем жиров, поэтому прежде всего действует на мембраны нервных клеток, вызывая фармакологический эффект - наркоз.
Разберем основные, чаще всего встречающиеся рецепторыне механизмы действия лекарственных средств.
Рецепторы в фармакологическом плане представляют собой функциональные биохимические макромолекулярные мембранные структуры, избирательно чувствительные к действию определенных химических соединений, а в нашем случае к действию лекарственных средств. Исследования последних лет показали, что фармакологические рецепторы представляют собой белки или ферменты (G-белки - одиночная пептидная цепь из 7 доменов) - в этом их принципиальное отличие от морфологических рецепторов.
Избирательная чувствительность лекарства к рецептору означает тот факт, что лекарственное вещество может, во-первых, связываться с рецептором, то есть обладает аффинитетом или сродством к нему. Другими словами, сродство или аффинитет означает способность лекарственного вещества к связи с рецептором.
Сродство или аффинитет отражает кинетические константы, связывающие лекарственное вещество, рецептор и реакцию на молекулярном уровне. Взаимодействие лекарственных веществ с рецептором приводит к возникновению ряда биохимических и физиологических изменений в организме, которые выражаются в том или ином эффекте.
Второй характеристикой лекарственного вещества является способность его вызывать фармакологический ответ, эффект после взаимодействия с рецептором. Эта способность обозначается как внутренняя активность лекарственного средства или его эффективность. До определенной степени биологическая реакция регулируется путем изменения числа рецепторов и их чувствительности.
В процессе эволюции образовались рецепторы, чувствительные к разнообразным эндогенным регуляторам. Согласно рецепторной теории, механизм действия лекарственных средств заключается в изменении скорости функционирования специфических систем организма при воздействии естественных медиаторов или экзогенных веществ на рецепторы.
Лекарственные средства, действие которых связано с прямым возбуждением или повышением функциональных возможностей (способностей) рецепторов, называются АГОНИСТАМИ, а вещества, препятствующие действию специфических агонистов, - АНТАГОНИСТАМИ. Другими словами, если лекарственное вещество имеет обе характеристики (то есть и сродство и внутреннюю активность), то оно является агонистом. Поэтому, агонист - это вещество с высоким аффинитетом к рецептору и высокой внутренней активностью. Если же вещество имеет способность только связываться с рецептором (то есть обладает сродством), но при этом неспособно вызывать фармакологические эффекты, то оно вызывает блокаду рецептора и называется антагонистом.
Препараты, имеющие то же сродство к рецептору, что и агонист, или более слабое, но обладающие менее выраженной внутренней
активностью, называются частичными агонистами или агонистом-антагонистом. Эти препараты, используемые одновременно с агонистами, снижают действие последних вследствие их способности занимать рецептор.
Пример: атропин - имеет большую активность, чем ацетилхолин (эндогенный медиатор). Атропин провзаимодействует с рецепторами, но так как не имеет внутренней активности, физиологического эффекта не вызовет. Ввиду большего сродства к рецептору по сравнению с ацетилхолином, он будет препятствовать действию агониста, а именно ацетилхолина, а значит являться его антагонистом.
Лекарственные вещества могут действовать подобно или противоположно эндогенным медиаторам. Если лекарственное вещество действует подобно медиатору (ацетилхолину, норадреналину и др.), - такое вещество называется МИМЕТИК. Mim - корень "мим", пантомима, мимикрия. Отсюда холиномиметик, адреномиметик.
Лекарственное вещество, препятствующее взаимодействию медиатора с рецептором, называется блокатором (холиноблокатор, адреноблокатор, гистаминоблокатор и т. д.).
В литературе можно встретить термин "литик" (лизис - растворение, физический процесс). Термин довольно старый, однако иногда используется (холинолитик, адренолитик). Таким образом, термины "литик" и "блокатор" используют как синонимы.
В медицинской практике все более широкое применение находит одновременное назначение нескольких лекарственных средств. При этом они могут взаимодействовать друг с другом, изменяя выраженность и характер основного эффекта, его продолжительность или ослабляя побочные и токсические влияния. В этой связи специальный раздел фармакодинамики посвящен ВЗАИМОДЕЙСТВИЮ ЛЕКАРСТВЕННЫХ СРЕДСТВ, которое классифицируют следующим образом. Выделяют ФАРМАКОЛОГИЧЕСКОЕ взаимодействие и ФАРМАЦЕВТИЧЕСКОЕ взаимодействие.
Фармацевтическое взаимодействие связано с фармацевтической несовместимостью лекарств в процессе их изготовления или хранения, а также при смешивании в одном шприце. При этом имевшаяся ранее фармакологическая активность у препаратов снижается или исчезает, а иногда появляются даже новые, токсические свойства.
Фармакологическое взаимодействие лекарств связано с изменениями их фармакокинетики, фармакодинамики или основано на химическом и физико-химическом взаимодействии в средах организма. При этом лекарственные препараты могут взаимодействовать друг с другом на любом этапе прохождения их через организм больного: при всасывании, в транспортной фазе, в процессе метаболизма, а также экскреции (фармакокинетическое взаимодействие).
Фармакодинамическое взаимодействие отражает изменение вызываемых каждым препаратом в отдельности процессов, связанных с реализацией эффекта. Иначе говоря, фармакодинамический тип взаимодействия основан на особенностях изменений механизмов и локализации действия используемых лекарственных средств, их основных эффектов. Если взаимодействие осуществляется на уровне рецепторов, то оно в основном касается агонистов и антагонистов различных типов рецепторов. При этом одно лекарственное вещество может усиливать или ослаблять действие другого. Если лекарственные ве
щества действуют в отношении эффекта однонаправленно - это препараты синергисты (син - вместе, эрго - работа). Таким образом, синергизм сопровождается усилением конечного эффекта. Как правило, эти лекарственные вещества действуют на одни и те же рецепторы. Выделяют 2 варианта синергизма:
1) Эффекты совпадают по принципу простой суммы. Суммированный (или аддитивный, - лат. - additio - прибавление). Эффект наблюдается при простом сложении эффектов каждого из компонентов. Например, так взаимодействуют средства для наркоза (закись азота + фторотан). Аналогичен вариант аддитивного эффекта при одновременном использовании аспирина и анальгина. Зачем это надо знать? Если аспирин больной вынужден принимать длительное время, то нужно учесть, что Аспирин действует ульцерогенно, то есть вызывает изъязвления слизистой оболочки ЖКТ, а Анальгин обладает таким нежелательным эффектом как угнетение кроветворения. Учитывая аддитивный анальгетический эффект, можно без существнного риска его возникновения снизить, существенно уменьшить дозировки обоих средств, принимаемых больным.
2) Второй вариант синергизма - потенцирование или усиление эффекта. Данный вариант возникает тогда, когда при введении двух веществ общий эффект превышает сумму эффектов обоих средств. В качестве примера можно привести взаимодействие нейролептиков (аминазин) и средств для наркоза, взаимодействие антибиотиков и противомикробных сульфониламидов.
Иногда выделяют третий (3) вариант синергизма, - сенситизацию. Сенситизация - когда один препарат в минимальной дозе усиливает действие другого в их комбинации (применение малых доз инсулина в сочетании с KCl увеличивает уровень проникновения калия в клетки).
Кроме синергизма существует явление антагонизма. Способность одного вещества в той или иной степени уменьшать эффект другого называют АНТАГОНИЗМОМ, то есть в данном случае одно лекарственное средство препятствует действию другого.
Выделяют физический, химический и физиологический антагонизм. Данный вид взаимодействия чаще всего используется при передозировке или остром отравлении лекарственными средствами. Примером ФИЗИЧЕСКОГО антагонизма может быть указана способность адсорбирующих средств затруднять всасывание веществ из пищеварительного тракта (активированный уголь, адсорбирующий на своей поверхности яд; холестирамин).
Иллюстрацией ХИМИЧЕСКОГО взаимодействия может быть образование комплексонов (ионы некоторых тяжелых металлов - ртути, свинца - связывает пенициламин, ЭДТА), или так взаимодействует соляная кислота желудка и бикарбонат натрия (щелочь).
ФИЗИОЛОГИЧЕСКИЙ антагонизм связан со взаимодействием лекарств на уровне рецепторов, о характере которого уже говорилось выше.
По аналогии с синергизмом выделяют ПРЯМОЙ (когда оба лекарственных соединения действуют на одни и те же рецепторы) и КОСВЕННЫЙ (разная локализация действия лекарственных средств) антагонизм. В свою очередь прямой антагонизм бывает КОНКУРЕНТНЫЙ и НЕ
КОНКУРЕНТНЫЙ. При конкурентном антагонизме лекарственное вещество вступает в конкурентные отношения с естественными регуляторами (медиаторами) за места связывания в специфических рецепторах. Блокада рецептора, вызванная конкурентным антагонистом, может быть снята большими дозами вещества-агониста или естественного медиатора.
Неконкурентный антагонизм - это та ситуация, когда лекарственное вещество не может вытеснить естественный медиатор из рецептора, но образует с ним (медиатором) ковалентные связи.
ТОЧКИ ВЗАИМОДЕЙСТВИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ Основная
масса рецепторов расположена на наружной и внутренней стороне мембраны клетки и ее органеллах. К наиболее частым точкам взаимодействия ЛС относятся: 1) медиаторы и гормональные рецепторы; 2) АТФ-фаза Na /K насоса, Ca , K и Na - внутримембранные каналы.
Последнее еще раз доказывает, что ЛС действуют на доступные ключевые механизмы билогических реакций, то есть на филогенетически детерминированные процессы, а не путем создания каких-то новых реакций.
Взаимодействие ЛС с рецептором происходит на уровне химических или физико-химических процессов. Наиболее часто характер реакции, ее сила, обратимость и длительность обусловлены свойствами связи ЛС с рецептором. Прочность связи зависит от расстояния электростатического взаимодействия между двумя атомами. Как правило, характер взаимодействия сложен, в нем могут участвовать различные виды связи, что определяется комплементарностью ЛС и рецептора, степенью сближения их между собой.
Самые слабые связи - вандерваальсовы (определяют специфичность взаимодействия веществ с реактивными системами). В большинстве случаев между ЛС и рецептором возникают ионные связи (обратимый характер).
ВИДЫ ДЕЙСТВИЯ ЛЕКАРСТВ
1) МЕСТНОЕ ДЕЙСТВИЕ - действие вещества, возникающее на месте его приложения. Пример: использование местных анестетиков - внесение раствора дикаина в полость конъюктивы. Использование 1% раствора новокаина при экстракции
зуба. Этот термин (местное действие) несколько условен, так как истинно местное действие наблюдается крайне редко, в силу того, что так как вещества могут частично всасываться, либо оказывать рефлекторное действие.
2) РЕФЛЕКТОРНОЕ ДЕЙСТВИЕ - это когда лекарственное вещество действует на путях рефлекса, то есть оно влияет на экстеро- или интерорецепторы и эффект проявляется изменением состояния либо соотвтетствующих нервных центров, либо исполнительных органов. Так, использование горчичников при патологии органов дыхания улучшает их трофику рефлекторно (эфирное горчичное масло стимулирует экстерорецепторы кожи). Препарат цититон (дыхательный аналептик) оказывает возбуждающее действие на хеморецепторы каротидного клубочка и, рефлекторно стимулируя центр дыхания, увеличивает объем и частоту дыхания. Другой пример - использование нашатырного спирта при обмороке (аммиак), рефлекторно улучшающего
мозговое кровообращение и тонизирующго жизненные центры.
3) РЕЗОРБТИВНОЕ ДЕЙСТВИЕ - это когда действие вещества развивается после его всасывания (резорбция - всасывание; лат. - resorbeo - поглащаю), поступления в общий кровоток, затем в ткани. Резорбтивное действие зависит от путей введения лекарственного средства и его способности проникать через биологические барьеры. Если вещество взаимодействует только с функционально одноз начными рецепторами определенной локализации и не влияет на другие рецепторы, действие такого вещества называется ИЗБИРАТЕЛЬНЫМ. Так, некоторые курареподобные вещества (миорелаксанты) довольно избирательно блокируют холинорецепторы концевых пластинок, вызывая расслабление скелетных мышц. Действие препарата празозина связано с избирательным, блокирующим постсинаптические альфа-один адренорецепторы эффектом, что ведет в конечном счете к снижению артериального давления. Основой избирательности действия ЛС (селективности) является сродство (аффинитет) вещества к рецептору, что определяется наличием в молекуле этих веществ определенных функциональных группировок и общей структурной организацией вещества, наиболее адекватной для взаимодействия с данными рецепторами, то есть КОМПЛЕМЕНТАРНОСТЬЮ.
ОБЩАЯ ХАРАКТЕРИСТИКА ДЕЙСТВИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ НА ОРГАНИЗМ
Несмотря на обилие лекарственных средств, все имзенения,
вызывавемые ими в организме, имеют определенную общность и
однотипность. Исходя из понятия нормы реакции, различают 5
типов изменений,
вызываемых фармакологическими средствами (Н. В. Вершинин):
1) тонизирование (повышение функции до нормы);
2) возбуждение (повышение функции сверх нормы);
3) успокаивающее действие (седативное), то есть понижение повышенной функции до нормы;
4) угнетение (снижение функции ниже нормы);
5) паралич (прекращение функции). Сумма тонизирующего и воз
буждающего эффектов называетсярующим действием.
ОСНОВНЫЕ ЭФФЕКТЫ ЛЕКАРСТВ
Прежде всего, различают:
1) физиологические эффекты, когда лекарства вызывают такие изменения, как повышение или снижение АД, частоты сердечных сокращений и т. д.;
2) биохимические (повышение уровня ферментов в крови, глюко
зы и т. д.). Кроме того, выделяют ОСНОВНЫЕ (или главные) и
НЕОСНОВНЫЕ (второстепенные) эффекты лекарств. ОСНОВНОЙ ЭФ
ФЕКТ - это тот, на котором врач строит свои расчеты при лечении данного (!) больного (анальгетики - для обезболивающего эффекта, гипотензивные - для снижения АД и т. п.).
НЕОСНОВНЫЕ, или неглавные эффекты, дополнительные иначе, те, которые присущи данному средству, но развитие которых у данного больного необязательно (анальгетики ненаркотические - помимо обезболивающего эффекта вызывают жаропонижающий эффект и т. п.). Среди неосновных эффектов могут быть ЖЕЛАТЕЛЬНЫЕ и НЕЖЕЛАТЕЛЬНЫЕ (или ПОБОЧНЫЕ) эффекты.
Пример. Атропин - расслабляет гладкую мускулатуру внутренних
органов. Однако при этом же он одновременно улучшает проводимость в АВузле сердца (при блокаде сердца), увеличивает диаметр зрачка и т. д. Все эти эффекты нужно рассматривать индивидуально в каждом конкретном случае.
ФАКТОРЫ, ВЛИЯЮЩИЕ НА ВЕЛИЧИНУ ЭФФЕКТА ЛЕКАРСТВЕННЫХ
1) Прежде всего, нужно помнить о фармакокинетических факторах, свойственных каждому препарату. Об этом уже говорилось выше, напомню лишь, что речь идет о своей скорости всасывания или абсорбции, биотрансформации, экскреции (препарата, лекарственного средства).
2) Вторая группа факторов - физиологические.
а) Возраст. Действительно, все хорошо знают о том, что с возрастом меняется чувствительность больного к лекарственным средствам. Выделились даже в связи с этим:
Перинатальная фармакология;
Педиатрическая фармакология;
Гериатрическая фармакология;
Репродуктивная фармакология;
б) Масса больного. Известно, что чем больше масса, тем выше
доза. Поэтому ЛС дозируют в (мг/кг).
в) Пол. Выявляется разная чувствительность у мужчин и женщин
к некоторым веществам, например, к никотину, алкоголю и т. п.,
что объясняется различием метаболизма, разницей удельного
веса жировой прослойки и т. п
в) Состояние организма. Действие ЛС на организм после су
щественной физической нагрузки будет иным, чем без таковой.
д) Биологические ритмы (суточные, месячные, сезонные, годо
вые, а сейчас даже популяционные) оказывают самое серьезное
влияние на действие ЛС в организме. 3) Патологические факто
ры (например уровень гормональной активности). Так при ба
зедовой болезни легче переносят токсические дозы морфина, но повышается чувствительность миокарда к адреналину. 1 0Эффект сердечных гликозидов на кровообращение проявляется только на фоне сердечной недостаточности. Действие ЛС существенно изменяется при гипо- и гипертермии, при инфекционных заболеваниях, при изменении функционального состояния ЦНС и т. д.).
4) Генетические факторы. Известно, что отсутствие фермента глюкозо-6-фосфатдегидрогеназы (Г-6-ФДГ) при талассении, делает невозможным назначение антималярийных препаратов типа примахин. Недостаточность фермента бутирилхолинэстеразы в крови, встречающаяся у одного из 2500 человек, является причиной длительной миорелаксации на введение дитилина.
5) Внушабельность больных или плацебо эффект. В этом плане антиангинальный эффект лекарств плацебо, например, достигает 40% и до 81% эффект-плацебо возникает от инъекционного пути введения препаратов. Вероятно поэтому использование витаминных препаратов, тонизирующих средств, транквилизаторов во многом обусловлены этим эффектом.
6) Доза лекарства. Действие ЛС в очень большой степени определяется их дозой. Дозой называют количество лекарственного ве
щества, предназначенное на один прием (обычно обозначается как разовая доза). От дозы лекарственного средства зависит не только эффективность лечения, но и безопасность больного. Еще в конце ХУШ века Вильям Визеринг писал: "Яд в малых дозах - лучшее лекарство; полезное лекарство в слишком большой дозе - яд". Это тем более правильно в наше время, когда в медицинскую практику введены чрезвычайно активные лекарственные средства, дозировки которых измеряются долями миллиграмма.
Обозначают дозу в граммах или в долях грамма. Для более точной дозировке препаратов рассчитывают их количество на 1 кг массы тела (или на 1 кв. м площади тела), например, 1мг/кг; 1 мкг/кг и т. д. Врачу необходимо быть ориентированным не только в дозе, рассчитанной на однократный прием (pro dosi), но и в суточной дозе (pro die).
Минимальные дозы, в которых лекарственные средства вызывают начальный биологический (терапевтический) эффект, называются пороговыми, или минимально действующими (терапевтическими) дозами. В практической медицине чаще всего используют средние терапевтические дозы, в которых лекарственные средства оказывают необходимое оптимальное фармакотерапевтическое действие. Если при их назначении больному эффект недостаточно выражен, дозу повышают до высшей терапевтической дозы. Высшие терапевтические дозы могут быть разовыми и суточными. Высшая разовая доза - это максимальное количество лекарственного препарата, которое без вреда для больного может быть введено однократно. Этими дозами пользуются редко, в крайних случаях (в ургентной, неотложной ситуации). Средние терапевтические дозы составляют обычно 1/3-1/2 от высшей разовой дозы.
Высшие терапевтические дозы ядовитых и сильнодействующих веществ приведены в Государственной фармакопее СССР. В некоторых случаях, например, при использовании химиотерапевтических средств, указывается доза препарата на курс лечения (курсовая доза). Если возникает необходимость быстро создать высокую концентрацию лекарственного средства в организме (сепсис, сердечно-сосудистая недостаточность), то пользуются первой дозой, так называемой ударной дозой, которая превышает все последующие. Различают также токсические (оказывающие опасные эффекты) и смертельные дозы.
Врачу важно знать еще одну характеристику, - а именно понятие о широте терапевтического действия препарата. Под широтой терапевтического действия понимают расстояние, диапазон от минимально терапевтической до минимальнотоксической дозы. Естественно, что чем больше эта дистанция, тем более безопасен данный препарат.
1/20 дозы х количество лет ребенку.
Для количественной характеристики и оценки эффективности нового фармакологического средства применяют, как правило, два стандартных сравнения - либо с плацебо, либо с препаратом анало
гичного типа действия, являющимся одним из наиболее эффективных в данной группе средств.
Плацебо (пустышка) - это индифферентное вещество в лекарственной форме, имитирующей определенное фармакологическое или лекарственное средство. Применение плацебо необходимо при наличии: а) эффекта предположительности, воздействия личности, ожидания и предвзятого отношения со стороны больного или исследователя; б) спонтанных изменений в течении болезни, симптомов, а также явлений, не связанных с лечением.
Плацебо - латинский термин, означающий: "Я могу доставить вам удовольствие".
Эффект плацебо - это эффект, вызываемый не специфическими фармакодинамическими свойствами препарата при данной патологии, а ФАКТОМ ПРИМЕНЕНИЯ препаратов, который воздействует психологически. Препараты плацебо обычно фармакологически инертны, они содержат неактивные вещества, подобные крахмалу или лактозе. Плацебо используют в клинических исследованиях для того, чтобы установить эффект внушения со стороны как больного, так и врача, особенно если изучению подлежат средства, предназначенные для лечения бронхиальной астмы, гипертонической болезни, стенокардии, ИБС. В таких случаях препарат плацебо не должен по цвету и другим физическим свойствам (запах, вкус, форма) отличаться от активного препарата. Плацебо более эффективно, когда и врач, и больной мало информированы о нем.
ПРИМЕР. При ишемической болезни сердца (ИБС) если одной группе больных с ИБС назначаем активное лекарство, а другой - плацебо, то у 40% больных второй группы приступы стенокардии купируются.
Наиболее выраженный эффект плацебо (до 81%) наблюдают при иньекционном пути введения его. Микстуры и пилюли менее эффективны.
В литературе, посвященной лекарственному воздействию на больного, часто звучит термин ФАРМАКОТЕРАПИЯ (ФТ). Фармакотерапия - раздел фармакологии, изучающий терапию больного лекарственными препаратами.
Различают следующие виды фармакотерапии:
1) ЭТИОТРОПНАЯ - идеальный вид фармакотерапии. Этот вид ФТ направлен на устранение причины болезни. Примерами этиотропной ФТ могут быть лечение противомикробными средствами инфекционных больных (бензилпенициллин при стрептококковой пневмонии), применение антидотов при лечении больных с отравлениями токсическими
веществами. 2) ПАТОГЕНЕТИЧЕСКАЯ ФАРМАКОТЕРАПИЯ - направлена
на устранение или
подавление механизмов развития болезни. Большинство применяемых в настоящее время лекарств относится именно к группе препаратов патогенетической ФТ. Антигипертензивные средства, сердечные гликозиды, антиаритмические, противовоспалительные, психотропные и многие другие лекарственные препараты оказывают терапевтическое действие путем подавления соответствующих механизмов развития заболевания.
3) СИМПТОМАТИЧЕСКАЯ ТЕРАПИЯ - направлена на устранение или
ограничение отдельных проявлений болезни. К симптоматическим лекарственным средствам можно отнести обезболивающие препараты, не влияющие на причину или механизм развития болезни. Противокашлевые средства - также хороший пример симптоматических средств. Иногда эти средства (устранение болевого синдрома при инфаркте миокарда) могут оказывать существенное влияние на течение основного патологического процесса и при этом играть роль средств патогенетической терапии.
4) ЗАМЕСТИТЕЛЬНАЯ ФАРМАКОТЕРАПИЯ используется при дефиците естественных биогенных веществ. К средствам заместительной терапии относятся ферментные препараты (панкреатин, панзинорм и т. д.), гормональные лекарственные средства (инсулин при сахарном диабете, тиреоидин при микседеме), препараты витаминов (витамин Д, например, при рахите). Препараты заместительной терапии, не устраняя причины заболевания, могут обеспечивать нормальное существование организма в течение многих лет. Не случайно такая тяжелая паталогия как сахарный диабет - считается особым стилем жизни у американцев.
5) ПРОФИЛАКТИЧЕСКАЯ ТЕРАПИЯ проводится с целью предупреждения заболеваний. К профилактическим относятся некоторые противовирусные средства (например, при эпидемии гриппа - ремантадин), дезинфицирующие препараты и ряд других. Применение противотуберкулезных препаратов типа изонизида также можно считать профилактической ФТ. Хорошим примером проведения профилактической терапии является использование вакцин.
От фармакотерапии следует отличать ХИМИОТЕРАПИЮ. Если ФТ имеет дело с двумя участниками патологического процесса, а именно - лекарством и макроорганизмом, то при химиотерапии имеется уже 3 участника: лекарство, макроорганизм (больной) и возбудитель болезни.
Говоря о дозах, мы прежде всего имели указывали на аллопатические дозы, в отличии от гомеопатических. Поэтому несколько слов о ГОМЕОПАТИИ. Термин "гомеопатия" образован от двух греческих слов: homois - подобный и pathos - страдание, болезнь. Дословно гомеопатия переводится как подобная, сходная болезнь. Основатель гомеопатии немецкий ученый Самуэль Ганеман в своей знаменитой книге "Органон врачебного искусства или основная теория гомеопатического лечения" еще в начале XIX столетия (1810 год) изложил основные принципы этой науки. Принципов этих несколько, но 2 из них являются основными:
1) Это закон подобия, который гласит, что лечение болезней необходимо осуществлять подобным, сходным средством. Согласно этому принципу Ганеман советует "подражать природе, которая иногда излечивает хроническую болезнь посредством другой присоединяющейся болезни". Поэтому "против болезни, подлежащей излечению (преимущественно хронической), следует применять такое лекарственное вещество, которое в состоянии вызвать другую, наивозможно сходную искусственную болезнь, и первая будет излечена". Similia
similibus (подобное подобным). Наример, желтуху следует лечить желтым и т. п.
2) Второй принцип - лечить супермалыми дозами. Разведения лекарственных средств, используемые гомеопатами исчисляются несколькими порядками, иногда доходя до их десятков: 10 в пятой; 10 в десятой; 10 в восемнадцатой и более степени(то есть миллионные
и более доли граммов). Чтобы объяснить эффект применения ле
карственных веществ в
высоких разведениях Ганеман выдвинул умозрительную концепцию: "Малые дозы отличаются особой духовной силой, большей активностью, способностью проникать в пораженные органы и ткани".
Не известно, как насчет особой духовной силы, но научная жизнь в последнее десятилетие предъявила очень серьезные доказательства для справедливости утверждения Ганемана. Так, например, опыты француза Жака Беквениста, произведенные им с разведением веществ в 10 в восьмидесятой степени раз показали, что молекулы воды обладают "памятью" на присутствие данного вещества, вызывая определенный физиологический эффект. Если отмеченный данный факт найдет в ближайшем будущем подтверждение, то есть если установят, не являются ли молекулы воды источником информации, безусловно мы будет стоять у основ величайшего открытия, смогущего объяснить и терапевтическую эффективность гомеопатических средств.
Далее рассмотрим раздел, касающийся ФАРМАКОЛОГИЧЕСКИХ АСПЕКТОВ ТОКСИЧЕСКОГО ДЕЙСТВИЯ ЛЕКАРСТВ, а именно ТОКСИКОЛОГИЮ ЛЕКАРСТВ. Токсикология лекарств - раздел фармакологии, который изучает токсические эффекты этих средств. Однако сейчас более правильно говорить о нежелательных реакциях организма человека на лекарства. Данный факт известен давно, накоплен богатый фактический материал, свидетельствующий о том, что нежелательные реакции разной степени могут возникать при приеме почти всех лекарственных препаратов.
Существует много классификаций побочных эффектов лекарственных средств и осложнений фармакотерапии, хотя ни одна из них не совершенна. Вместе с тем, исходя из патогенетического принципа, все нежелательные эффекты или реакции можно подразделить на 2 типа:
1) нежелательные реакции, связанные с
а) передозировкой лекарств
б) отравлениями;
2) токсические реакции, связанные с фармакологическими свойствами лекарств.
Передозировка возникает обычно при использовании высоких доз препаратов. Особенно часто передозировка возникает при приеме лекарственных средств, имеющих малую широту терапевтического действия. Например, проявлений токсичности трудно избежать при использовании антибиотиков аминогликозидов (стрептомицина, канамицина, неомицина). Названные препараты вызывают вестибулярные нарушения и глухоту при лечении в дозах, которые ненамного превышают терапевтические. Для некоторых лекарств просто невозможно избежать токсических осложнений (противоопухолевые, цитотоксические препараты), которые повреждают все быстро делящиеся клетки и уг
нетают косный мозг при одновременном эффективном воздействии на рост опухолевых клеток.
Кроме того, передозировка может быть связана не только с использованием высоких доз, но и с явлением кумуляции (сердечные гликозиды).
Отравления могут быть случайные и преднамеренные. Преднамеренные отравления обычно происходят с суициидальной целью (с целью самоубийства). По Омской области наиболее часто в общей структуре отравлений занимают отравления прижигающими жидкостями, на втором месте стоят лекарственные отравления. Это, прежде всего, отравления снотворными, транквилизаторами, ФОС, алкоголями, угарным газом.
Несмотря на различие этиологических факторов, меры помощи на этапах врачебного пособия прнципиально схожи.
Эти принципы следующие:
1) БОРЬБА С НЕВСОСАВШИМСЯ ЯДОМ ИЗ ЖКТ. Чаще всего это требуется при пероральном отравлении ядом. Наиболее часто острые отравления вызваны приемом веществ внутрь. Обязательным и экстренным мероприятием в этом плане является промывание желудка через зонд даже спустя 10-12 часов после отравления. Если больной в сознании, промывание желудка осуществляется с помощью большого количества воды и последующего вызывания рвоты. Рвоту вызывают механическим путем. В бессознательном состоянии промывание желудка больному осуществляют через зонд. Необходимо направить усилия на адсорбцию находящегося в желудке яда, для чего используют активированный уголь (по 1 столовой ложке внутрь, либо 20-30 таблеток одновременно, до и после промывания желудка). Желудок промывают несколько раз через 3-4 часа до полного очищения от вещества.
Рвота противопоказана в следующих случаях:
При коматозных состояниях;
При отравлении коррозивными жидкостями;
При отравлении керосином, бензином (возможность гидрокарбонатной пневмонии с некрозом ткани легкого и т. д.).
Если пострадавший является маленьким ребенком, то для промывания лучше использовать солевые растворы в малых объемах (100-150 мл).
Из кишечника яд лучше всего удалять с помощью солевых слабительных. Поэтому по окончании промывания можно ввести в желудок 100-150 мл 30% раствора сульфата натрия, а еще лучше сульфата магния. Солевые слабительные являются самыми мощными, быстро действующими на протяжении всего кишечника. Действие их подчиняется законам осмоса, поэтому они в течение короткого периода времени прекращают действие яда.
Хорошо дать вяжущие (растворы танина, чай, черемуха), а также обволакивающие (молоко, белок яиц, растительное масло).
При накожном попадании яда необходимо тщательно промыть кожные покровы, лучше всего пробочной водой. При попадании токсических веществ через легкие следует прекратить их ингаляцию, удалив пострадавшего из отравленной атмосферы.
При подкожном введении токсического вещества всасывание его из места введения можно замедлить инъекциями раствора адреналина
вокруг места введения вещества, а также охлаждением этой области (лед на кожу в месте инъекции).
2) Второй принцип помощи при остром отравлении заключается в ВОЗДЕЙСТВИИ НА ВСОСАВШИЙСЯ ЯД, УДАЛЕНИЕ ЕГО ИЗ ОРГАНИЗМА.
С целью скорейшего выведения токсического вещества из организма применяют прежде всего, форсированный диурез. Суть этого метода заключается в сочетании усиленной водной нагрузки с введением активных, мощных мочегонных средств. Наводнение организма осуществляем путем обильного питья больному или введения в/в различных растворов (кровезамещающие растворы, глюкоза и т. п.). Из мочегонных наиболее часто используют ФУРОСЕМИД (лазикс) или МАННИТ. Методом форсированного диуреза мы как бы "промываем" ткани больного, освобождая их от токсического вещества. Этим способом удается лишь вывести только свободные вещества, не связанные с белками и липидами крови. Следует учитывать электролитный баланс, который при использовании данного метода может быть нарушен вследствие выведения из организма значительного количества ионов.
При острой сердечно-сосудистой недостаточности, выраженном нарушении функции почек и опасности развития отека мозга или легких форсированный диурез противопоказан.
Помимо форсированного диуреза используют гемодиализ и перитонеальный диализ, когда кровь (гемодиализ, или искусственная почка) проходит через полупроницаемую мембрану, освобождаясь от токсических веществ, или осуществляется "промывание" полости брюшины раствором электролитов.
МЕТОДЫ ЭКСТРАКОРПОРАЛЬНОЙ ДЕТОКСИКАЦИИ. Удачным методом детоксикации, получившим широкое распространение, является метод ГЕМОСОРБЦИИ (лимфосорбции). В данном случае токсические вещества, находящиеся в крови, адсорбируются на специальных сорбентах (гранулированный уголь с покрытием белками крови, аллоселезенка). Этот метод позволяет успешно проводить детоксикацию организма при отравлениях нейролептиками, транквилизаторами, ФОС и др. Методом гемосорбции выводятся вещества, плохо удаляющиеся гемодиализом и перитонеальным диализом.
Используют ЗАМЕЩЕНИЕ КРОВИ, когда сочетают кровопускание с переливанием донорской крови.
3) Третий принцип борьбы с острым отравлением заключается в ОБЕЗВРЕЖИВАНИИ ВСОСАВШЕГОСЯ ЯДА путем введения АНТАГОНИСТОВ и АНТИДОТОВ.
Антагонисты широко используют при острых отравлениях. Например, атропин при отравлениях антихолинэстеразными средствами, ФОС; налорфин - при отравлении морфином и т. д. Обычно фармакологические антагонисты конкурентно взаимодействуют с теми же рецепторами, что и вещества, вызвавшие отравление. В этом плане очень интересным выглядит создание СПЕЦИФИЧЕСКИХ АНТИТЕЛ (моноклональных) в отношении веществ, которые особенно часто являются причиной острых отравлений (моноклональные антитела против сердечных гликозидов).
Для специфического лечения больных с отравлениями химическими веществами эффективна АНТИДОТНАЯ ТЕРАПИЯ. АНТИДОТАМИ называют средства, применяемые для специфического связывания яда, нейтра
лизующие, инактивирующие яды либо посредством химического или физического взаимодействия.
Так, при отравлении тяжелыми металлами применяют соединения, которые образуют с ними нетоксичные комплексы (например, унитиол при отравлениях мышьяком, Д-пенициламин, десфераль при отравлениях препаратами железа и т. д.).
4) Четвертый принцип состоит в проведении СИМПТОМАТИЧЕСКОЙ ТЕРАПИИ. Особенно большое значение симптоматическая терапия приобретает при отравлениях веществами, которые не имеют специальных антидотов.
Симптоматической терапией поддерживают жизненно важные функции: КРОВООБРАЩЕНИЕ и ДЫХАНИЕ. Используют сердечные гликозиды, вазотоники, средства, улучшающие микроциркуляцию, оксигенотерапию, стимуляторы дыхания. Судороги устраняют инъекциями сибазона. При отеке мозга проводят дегидратационную терапию (фуросемид, маннит). применяют анальгетики, проводят коррекцию кислотно-щелочного состояния крови. При остановке дыхания переводят больного на искусственную вентиляцию легких с комплексом реанимационных мер.
Далее остановимся на ВТОРОМ ТИПЕ НЕЖЕЛАТЕЛЬНЫХ РЕАКЦИЙ, то есть нежелательных реакциях, связанных с фармакологическими свойствами лекарств. Побочные эффекты лекарств проявляются у 10-20% амбулаторных больных, а 0, 5-5% больных нуждаются в госпитализации для коррекции нарушений от ЛС. Эти нежелательные, с точки зрения патогенеза, реакции могут быть: а) ПРЯМЫМИ и б) связанные с ИЗМЕНЕННОЙ ЧУВСТВИТЕЛЬНОСТЬЮ организма больного.
Разберем ПРЯМЫЕ ТОКСИЧЕСКИЕ РЕАКЦИИ. Они называются прямыми потому, что лекарства прямо, непосредственно токсически действуют на функциональную систему. Например, антибиотики аминогликозидного ряда (стрептомицин, канамицин, гентамицин) проявляют НЕЙРОТОКСИЧНОСТЬ, оказывая токсическое влияние на орган слуха (ототоксичность) и вестибулярный аппарат. К тому же данный класс антибиотиков оказывает токсичность в отношении поведенческих реакций, проявляющихся вялостью, аппатией, заторможенностью, сонливостью.
Лекарства могут оказывать ПРЯМЫЕ ГЕЛАТОТОКСИЧЕСКИЕ РЕАКЦИИ. Например, фторотан (средство для наркоза) при повторных применениях в короткие сроки может оказывать выраженный токсический эффект вплоть до острой желтой дистрофии печени.
Прямые токсические эффекты могут реализоваться НЕФРОТОКСИЧНОСТЬЮ. Таким эффектом обладают мициновые антибиотики-аминогликозиды. При назначении препаратов этого ряда больному нужен постоянный контроль за состоянием анализов мочи (белок, кровь в моче и т. п.).
Следующий прямой токсический эффект - УЛЬЦЕРОГЕННЫЙ (язвообразующий). Например, назначение салицилатов, глюкокортикоидов, антигипертензивного средства резерпина - ведет к изъязвлению слизистой оболочки желудка, что необходимо учитывать при назначении указанных классов средств, особенно больным, уже страдающим язвенной болезнью.
Прямые токсические эффекты могут выражаться в ЭМБРИОТОКСИЧНОСТИ. Напомню, что эмбриотоксическим называют неблагоприятное
действие лекарств, не связанное с нарушением органогенеза, возникающее до 12 недель беременности. А токсическое действие лекарств в более поздний период беременности называют ФЕТОТОКСИЧЕСКИМ. Необходимо помнить о данном эффекте при назначении лекарственных средств беременным женщинам, проводя им фармакотерапию только по строгим показаниям.
Примеры: 1) назначение беременным стрептомицина может привести к глухоте у плода (поражение VIII пары черепно-мозговых нервов); 2) тетрациклины отрицательно влияют на развитие костей у плода; 3) у матери, страдающей морфинизмом, новорожденный также может страдать физической зависимостью к морфину.
Лекарственные средства могут обладать ТЕРАТОГЕННОСТЬЮ, то есть таким повреждающим влиянием на дифференцировку тканей и клеток, которое приводит к рождению детей с разными аномалиями. Например, использование в качестве успокаивающего и снотворного средства ТАЛИДОМИДА, обладающего выраженным тератогенным эффектом, привело к рождению в странах Западной Европы нескольких тысяч детей с различными уродствами (фокомелия - ластоподобные конечности; амелия - отстутствие конечностей; гемангионы лица, аномалии ЖКТ).
Для изучения тератогенного действия веществ исследуют влияние препаратов на животных, хотя прямой корреляции о влиянии лекарственных веществ на животных и человека нет. Например, у того же талидомида тератогенность в эксперименте на мышах была выявлена в дозе 250-500 мг/кг массы, а у человека она оказалась равной 1-2 мг/кг.
Наиболее опасным в отношении тератогенного действия считается первый триместр (особенно период 3-8 недель беременности), то есть период органогенеза. В эти сроки особенно легко вызвать тяжелую аномалию развития эмбриона.
При создании новых лекарственных средств следует иметь также в виду возможность таких серьезных отрицательных эффектов, как ХИМИЧЕСКУЮ МУТАГЕННОСТЬ и КАНЦЕРОГЕННОСТЬ. МУТАГЕННОСТЬ - это способность веществ вызывать стойкое повреждение зародышевой клетки, но особенно ее генетического аппарата, что проявляется в изменении генотипа потомства. КАНЦЕРОГЕННОСТЬ - это способность веществ вызывать развитие злокачественных опухолей. Эстрагены способствуют развитию рака молочной железы у женщин в детородном возрасте.
Мутагенный и тератогенный эффекты могут проявиться спустя месяцы и даже годы, что затрудняет выявление их истинной активности. Тератогенность присуща антинеопластическим средствам, кортикостероидам, андрогенам, алкоголю. Канцерогенным действием обладают циклофосфамид, некоторые гормональные средства.
Нежелательные реакции при использовании лекарственных средств могут выражаться развитием ЛЕКАРСТВЕННОЙ ЗАВИСИМОСТИ или если более глобально - НАРКОМАНИЕЙ. Существует несколько основных признаков наркомании.
1) Это наличие ПСИХИЧЕСКОЙ ЗАВИСИМОСТИ, то есть такого состояния, когда у больного развивается неодолимое психическое влечение к повторному введению лекарственного вещества, например,
наркотика.
2) ФИЗИЧЕСКАЯ ЗАВИСИМОСТЬ - этим термином обозначают наличие у больного сильнейшего физического недомогания без повторной инъекции лекарственного вещества, в частности наркотика. При резком прекращении введения препарата, вызвавшего лекарственную зависимость, развивается явление ЛИШЕНИЯ или АБСТИНЕНЦИИ. Появляются страх, тревога, тоска, бессоница. Возможно двигательное беспокойство, возникает агрессивность. Нарушаются многие физиологические функции. В тяжелых случаях абстиненция может быть причиной смертельного исхода.
3) Развитие ТОЛЕРАНТНОСТИ, то есть привыкания. Другими вида
ми нежелательных эффектов, обусловленных свойствами самих лекарств, являются нарушения, связанные со сдвигами в иммунобиологической системе больного при приеме высокоактивных лекарственных средств. Например, использование антибиотиков широкого спектра действия может проявиться изменением нормальной бактериальной флоры организма (кишечника), реализуемое развитием суперинфекции, дисбактериозом, кандидозом. Чаще всего в указанные процессы вовлекаются легкие и кишечник.
Кортикостероидотерапия и иммуносупрессивная терапия ослабляют иммунитет, в результате чего повышается риск развития инфекционных заболеваний, прежде всего, оппортунистической природы (пневмоцистоз, цитомегаловирус и т. п.).
Эта подгруппа реакций бывает 2-х видов:
1) АЛЛЕРГИЧЕСКИЕ РЕАКЦИИ;
2) ИДИОСИНКРАЗИЯ. Следует сказать, что отрицательные влия
ния, связанные с
ческими реакциями, встречаются очень часто в медицинской практике. Их частота все время увеличивается. Возникают они независимо от дозы вводимого лекарственного средства, а в их формировании участвуют иммунные механизмы. Аллергические реакции могут быть 2-х видов: ГИПЕРЧУВСТВИТЕЛЬНОСТЬ НЕМЕДЛЕННОГО ТИПА, ГНТ - связанноя с образованием антител классов IgE и IgG4) и ЗАМЕДЛЕННОГО (накопление сенсибилизированных T-лимфоцитов и макрофагов) типов.
Клиническая картина очень многообразна: крапивница, кожные сыпи, ангионевротический отек, сывороточная болезнь, бронхиальная астма, лихорадка, гепатит и т. д. Но главное - возможность развития анафилактического шока. Если для развития аллергических реакций требуется как минимум двухкратный контакт больного с лекарственным веществом, то развитие ИДИОСИНКРАЗИИ - непереносимости лекарственных веществ при первичном контакте с ксенобиотиком, всегда связано с каким-либо ГЕНЕТИЧЕСКИМ ДЕФЕКТОМ, как правило выражающимся отсутствием или крайне низкой активностью фермента. Например, использование противомалярийного препарата примахина у лиц с генетической энзимопатией (недостаточность акт. г-6-ФДГ) вызывает образование хинона, который обладает гемолитическим действием. При наличии данной ферментопатии опасно назначение ЛС, являющихся окислителями, так как это может приводить к гемолизу
эритроцитов, к лекарственной гемолитической анемии (аспирин, левомицетин, хинидин, примахин, фурадонин).
НЕСКОЛЬКО СЛОВ О СОЗДАНИИ НОВЫХ ЛЕКАРСТВЕННЫХ СРЕДСТВ, ОЦЕНКЕ ЛЕКАРСТВ И ИХ НОМЕНКЛАТУРЕ. Прогресс фармакологии характеризуется непрерывным поиском и созданием новых препаратов. Создание лекарств начинается с исследований химиков и фармакологов, творческое сотрудничество которых абсолютно необходимо при открытии новых препаратов. При этом поиск новых средств развивается по нескольким направлениям.
Основным путем является ХИМИЧЕСКИЙ синтез препаратов, который может реализоваться в виде НАПРАВЛЕННОГО синтеза или иметь ЭМПИРИЧЕСКИЙ путь. Если направленный синтез связан с воспроизведением биогенных веществ (инсулин, адреналин, норадреналин), созданием антиметаболитов (ПАБК-сульфаниламиды), модификацией молекул соединений с известной биологической активностью (изменение структуры ацетилхолина - гонглиоблекатор гигроний) и т. д., то эмпирический путь состоит или из случайных находок, либо поиска путем скрининга, то есть просеивания различных химических соединений на фармакологическую активность.
Одним из примеров эмпирических находок может быть приведен случай обранужения гипогликемического эффекта при использовании сульфаниламидов, что впоследствии привело к созданию сульфаниламидных синтетических перфоральных противодиабетических средств (бутамид, хлорпропамид).
Весьма трудоемок и другой вариант эмпирического пути создания лекарств - МЕТОД СКРИНИНГА. Однако он неизбежен, особенно если исследуется новый класс химических соединений, свойства которых, исходя из их структуры, трудно прогнозировать (малоэффективный путь). И здесь огромную роль в настоящее время играет компьютеризация научного поиска.
В настоящее время лекарственные средства получают главным образом посредством направленного химического синтеза, который может осуществляться а) путем подобия (введение дополнительных цепочек, радикалов) б) путем комплементарности, то есть соответствия каким-либо рецепторам тканей и органов.
В арсенале лекарственных средств, помимо синтетических препаратов, значительное место занимают препараты и индивидуальные вещества из ЛЕКАРСТВЕННОГО СЫРЬЯ растительного или животного происхождения, а также из различных минералов. Это прежде всего галеновы, новогаленовы препараты, алкалоиды, гликозиды. Так из опия получают морфин, кодеин, папаверин, из рауфльфии змеевидной - резерпин, из наперстянки - сердечные гликозиды - дигитоксин, дигоксин; из ряда эндокринных желез крупного рогатого скота - гормоны, иммуноактивные препараты (инсулин, тиреоидин, тактивин и т. д.).
Некоторые лекарственные средства являются продуктами жизнедеятельности грибов и микроорганизмов. Пример - антибиотики. Лекарственные вещества растительного, животного, микробного, грибкового происхождения часто служат основой для их синтеза, а также последующих химических превращений и получения полусинтетических и синтетических препаратов.
Набирают темпы создания лекарственных средств путем исполь
зования методов генной инженерии (инсулин и т. п.).
Новое лекарственное средство, пройдя через все эти "сита" (исследование фармактивности, фармакодинамики, фармакокинетики, изучение побочных эффектов, токсичности и т. д.) допускается на клинические испытания. Здесь используется метод "слепого контроля", эффект плацебо, метод двойного "слепого контроля", когда ни врач, ни больной не знает, когда это плацебо используется. Знает только специальная комиссия. Клинические испытания проводятся на людях, и во многих странах это осуществляется на добровольцах. Здесь, безусловно, возникает масса юридических, деонтологических, нравственных аспектов проблемы, которые требуют своей четкой разработки, регламентации и утверждения законов на данный счет.
НОМЕНКЛАТУРА ЛЕКАРСТВЕННЫХ СРЕДСТВ
Многие лекарственные средства, состоящие из одного активного вещества, могут быть названы по их химическому строению. Но в связи с большой сложностью их запоминания и неудобством применения химические названия в медицинской практике не используются.
В настоящее время для обозначения лекарственных средств используют 2 вида названий:
1) НЕПАТЕНТОВАННЫЕ международные, которые утверждаются официальными органами здравоохранения и используются в национальных и международных фармакопеях;
2) КОММЕРЧЕСКИЕ, или фирменные названия, являющиеся коммерческой собственностью фармфирм. При этом один и тот же препарат может иметь множество названий. Транквилизатор диазенам имеет фирменные названия "седуксен", "сибазон", "реланиум" и т. д. Некоторые ЛС имеют более 100 наименований (например, витамин В12). Обычно на упаковке лекарственного препарата имеется как фирменное, так и международное непатентованное название.
Предпочтительным является выписывание лекарств под их непатентованными названиями, что снижает возможность врачебных ошибок. Такие препараты дешевле, чем медикаменты с фирменным названием. Кроме того, выписывание лекарства под их непатентованным названием дает возможность аптеке предоставить больному препарат любой фирмы, производящей данное лекарство.
Для клиницистов наиболее удобной классификацией лекарств является та, что строится по НОЗОЛОГИЧЕСКОМУ ПРИНЦИПУ (например, средства для лечения бронхиальной астмы, инфаркта миокарда, антидиабетические препараты и т. п.). Но лучшие классификации учитывают такие признаки препаратов, как локализация действия, фармакологическое действие, терапевтическое применение. Одной из таких классификаций, являющихся наиболее совершенной, является классификация академика М. Д. Машковского, согласно которой изложен и его известный справочник.
1. Понятие о лечении как направленной коррекции физиологических нарушений в организме. Польза и риск при использовании лекарств. Основания для их применения. Оценка безопасности.
Фармакология – теоретическая основа фармакотерапии.
Основания для применения лекарств:
1) для коррекции и устранения причины заболевания
2) при недостаточности профилактических средств
3) по жизненным показаниям
4) очевидная необходимость, основанная на уровне знаний и опыте
5) стремление к повышению качества жизни
Польза при назначении лекарств:
1) коррекция или устранение причины заболевания
2) облегчение симптомов заболевания при невозможности его лечения
3) замещение лекарственными веществами естественных БАВ, не вырабатываемых организмов в достаточном количестве
4) осуществление профилактики заболеваний (вакцины и др.)
Риск – вероятность того, что результатом воздействия будет вред или ущерб; равен отношению числа неблагоприятных (аверсивных) событий к численности группы риска.
А) неприемлемый (вред > пользы)
Б) приемлемый (польза > вреда)
В) незначительный (105 – уровень безопасности)
Г) осознанный
Оценка безопасности ЛС начинается на уровне химических лабораторий, синтезирующих ЛС. Доклиническую оценку безопасности ЛС проводит Минздрав, FDA и т. д. Если ЛС успешно проходит данный этап, начинается его клиническая оценка, состоящая из четырех фаз: I фаза – оценка переносимости на здоровых добровольцах 20-25 лет, II фаза – на больных добровольцах численностью менее 100 человек, страдающих определенным заболеванием, III фаза — мультицентровые клинические исследования на больших группах людей (до 1000 человек), IV фаза – мониторинг препарата на протяжении 5 лет после его официального разрешения. Если ЛС успешно проходит все эти фазы, оно считается безопасным.
2. Сущность фармакологии как науки. Разделы и области современной фармакологии. Основные термины и понятия фармакологии – фармакологическая активность, действие, эффективность химических веществ.
Фармакология – наука о лекарствах во всех аспектах – теоретическая основа терапии:
А) наука о взаимодействии химических веществ с живыми системами
Б) наука об управлении процессами жизнедеятельности организма с помощью химических веществ.
Разделы современной фармакологии:
1) Фармакодинамика – изучает а) воздействие ЛС на организм человека, б) взаимодействие различных ЛС в организме при одновременном их назначении, в) влияние возраста и различных заболеваний на действие ЛС
2) Фармакокинетика – изучает всасывание, распределение, метаболизм и экскрецию ЛС (т. е. как организм больного реагирует на ЛС)
3) Фармакогенетика – изучает роль генетических факторов в формировании фармакологического ответа организма на ЛС
4) Фармакоэкономика – оценивает результаты использования и стоимость ЛС для принятия решения о последующем их практическом применении
5) Фармакоэпидемиология – изучает применение ЛС и их эффекты на уровне популяций или больших групп людей для обеспечения применения наиболее эффективных и безопасных ЛС
Фармакологическая (биологическая) активность – свойство вещества вызывать изменения в биосистеме (организме человека). Фармакологические вещества = биологически активные вещества (БАВ)
Фармакологическое действие – влияние ЛС на объект и его мишени
Фармакологический эффект – результат действия вещества в организме (модификация физиологических, биохимических процессов, морфологических структур) – количественное, но не качественное изменение в состоянии биосистем (клеток, тканей, органов).
Эффективность ЛС – способность ЛС вызывать определенные необходимые в данном случае фармакологические эффекты в организме. Оценивается на основе «существенных доказательств» — адекватных хорошо контролируемых исследований и клинических испытаний, проводимых экспертами с соответствующей научной подготовкой и опытом в исследовании лекарств данного типа {FDA}
3. Химическая природа лекарств. Факторы, обеспечивающие терапевтический эффект лекарственных средств – фармакологическое действие и плацебо-эффекты.
ЛС бывают 1) растительного 2) животного 3) микробного 4) минерального 5) синтетического
Синтетические ЛС представлены практически всеми классами химических соединений.
Фармакологическое действие – влияние ЛС на объект и его мишени.
Плацебо – любой компонент терапии, не оказывающий никакого специфического биологического воздействия на болезнь, являющуюся объектом лечения.
Применяется с целью контроля при оценке действия ЛС и для того, чтобы принести пользу больному без каких-либо фармакологических средств в результате только психологического воздействия (т. е. Плацебо-эффекта ).
Все виды лечения имеют психологический компонент, либо доставляющий удовлетворения (Плацебо-эффект ), либо вызывающий беспокойство (Ноцебо-эффект ). Пример плацебо-эффекта: быстрое улучшение у больного вирусной инфекцией при применении антибиотиков, не влияющих на вирусы.
Благоприятность плацебо-эффекта связана с психологическим воздействием на пациента. Он будет максимальным лишь при его использовании В сочетании с методами лечения , имеющими выраженный специфический эффект. Дорогостоящие вещества в качестве плацебо также способствуют достижению большего ответа.
Показания к применению плацебо:
1) слабые психические нарушения
2) психологическая поддержка пациента с неизлечимой хронической болезнью или с подозрением на тяжелый диагноз
4. Источники и этапы создания лекарств. Определение понятий лекарственное вещество, лекарственное средство, лекарственный препарат и лекарственная форма. Название лекарств.
Источники создания ЛС:
А) натуральное сырье: растения, животные, минералы и т. д. {сердечные гликозиды, свиной инсулин}
Б) модифицированные природные БАВ
В) синтетические соединения
Г) продукты генной инженерии {рекомбинантный инсулин, интерфероны}
Этапы создания ЛС:
1. Синтез ЛС в химической лаборатории
2. Доклиническая оценка активности и нежелательных эффектов ЛС Минздравов и др. организмациями
3. Клинические испытания ЛС (подробнее см. в. 1)
Лекарственное средство – любое вещество или продукт, используемые, чтобы модифицировать или исследовать физиологические системы или патологические состояния для блага реципиента (по ВОЗ, 1966 г.); индивидуальные вещества, смеси веществ или композиции неизвестного состава, обладающие доказанными лечебными свойствами.
Лекарственное вещество – индивидуальное химическое соединение, используемое в качестве лекарственного средства.
Лекарственная форма – удобная для практического применения форма, придаваемая лекарственному средству для получения необходимого лечебного или профилактического эффекта.
Лекарственный препарат – лекарственное средство в определенной лекарственной форме, разрешенное органом государственного управления.
5. Пути введения лекарств в организм и их характеристика. Пресистемная элиминация лекарств.
1. Для системного действия
А. Энтеральный путь введения : перорально, сублингвально, трансбуккально, ректально, через зонд
Б. Парентеральный путь введения : внутривенно, подкожно, внутримышечно, ингаляционно, субарахноидально, трансдермально
2. Для местного воздействия: накожно (эпикутарно), на слизистые, в полости (брюшную, плевральную, суставную), в ткани (инфильтрация)
|
Путь введения ЛС |
Достоинства |
Недостатки |
|
Перорально – через рот |
1. Удобен и прост для пациента 2. Не требуется стерильности препаратов |
1. Абсорбция многих ЛС зависит от приема пищи, функционального состояния ЖКТ и др. факторов, с трудом учитывающихся на практике 2. Не все ЛС хорошо всасываются в ЖКТ 3. Некоторые ЛС разрушаются в желудке (инсулин, пенициллин) 4. Часть ЛС оказывает НЛР на слизистую ЖКТ (НПВС – изъявления слизистой, антациды – подавляют моторику) 5. Не применим у пациентов в бессознательном состоянии и при нарушении глотании |
|
Сублингвально и трансбуккально |
1. Удобное и быстрое введение 2. Быстрое всасывание ЛС 3. ЛС не подвергается пресистемной элиминации 4. Действие препарата можно быстро прервать |
1. Неудобство, создаваемое частым регулярным использованием таблеток 2. Раздражение слизистой рта, избыточное выделение слюны, способствующее заглатыванию ЛС и уменьшению его эффективности 3. Неприятный вкус |
|
Ректально |
1. Половина ЛВ не подвергается пресистемному метаболизму 2. Не раздражается слизистая ЖКТ 3. Удобно, когда другие пути введения неприемлимы (рвота, морская болезнь, грудные дети) 4. Местное действие |
1. Неприятные для пациента психологические моменты 2. Всасывание ЛС значительно замедляется при неопорожненной прямой кишке. |
|
Внутрисосудисто (обычно внутривенно |
1. Быстрое поступление в кровь (неотложные состояния) 2. Быстрое создание высокой системной концентрации и возможность ею управлять 3. Позволяет вводить ЛС, разрушающиеся в ЖКТ |
1. Технические сложности внутрисосудистого доступа 2. Риск развития инфекции в месте инъекции 3. Тромбозы вен в месте введения ЛС (эритромицин) и болевые ощущения (калия хлорид) 4. Некоторые ЛС адсорбируются на стенках капельниц (инсулин) |
|
Внутримышечно |
Достаточно быстрое всасывание препарата в кровь (10-30 мин) |
Риск местных осложнений |
|
Подкожно |
1. Больной может делать инъекции самостоятельно после обучения 2. Длительный эффект ЛС |
1. Медленное всасывание и проявление эффекта ЛС 2. Атрофия жировой ткани в месте введения и уменьшение скорости всасывания ЛС |
|
Ингаляционно |
1. Быстрое начало действия и высокая концентрация в месте введения при лечении заболеваний дых. путей 2. Хорошая контролируемость действия 3. Уменьшение токсических системных эффектов |
1. Необходимость специального устройства (ингалятора) 2. Сложность использования аэрозолей под давлением для некоторых больных |
|
Местный ЛС |
1. Высокая действующая концентрация ЛС в месте введения 2. Избегаются нежелательные системные эффекты данного ЛС |
При нарушении целостности кожных покровов препарат может попасть в системный кровоток – проявление нежелательных системных эффектов. |
Пресистемная элиминация ЛС (эффект первого прохождения) — процесс биотрансформации лекарства до попадания ЛС в системный кровоток. В пресистемной элиминации при пероральном введении лекарства участвуют ферментативные системы кишечника, крови воротной вены и гепатоциты.
При внутривенном введении пресистемная элиминация отсутствует.
Для того, чтобы перорально принимаемое ЛС оказало полезное действие, нужно увеличить его дозу для компенсации потерь.
6. Перенос лекарств через биологические барьеры и его разновидности. Основные факторы, влияющие на перенос лекарств в организме.
Способы абсорбции (транспорта) ЛС через биологические мембраны:
1) Фильтрация (водная диффузия) – пассивное перемещение молекул вещества по градиенту концентрации через заполненные водой поры в мембране каждой клетки и между соседними клетками, характерен для воды, некоторых ионов, мелких гидрофильных молекул (мочевина).
2) Пассивная диффузия (липидная диффузия) — основной механизм переноса ЛВ, процесс растворения лекарства в липидах мембраны и движение через них.
3) Транспорт при помощи специфических переносчиков – перенос ЛВ при помощи встроенных в мембрану переносчиков (чаще белков), характерен для гидрофильных полярных молекул, ряда неорганических ионов, сахаров, аминокислот, пиримидинов:
а) облегченная диффузия – осуществляется по градиенту концентрации без затраты АТФ
б) активный транспорт – против градиента концентрации с затратами АТФ
Насыщаемый процесс – т. е. скорость абсорбции увеличивается лишь до тех пор, пока количество молекул лекарственного вещества не сравняется с количеством переносчиков.
4) Эндоцитоз и пиноцитоз — лекарство связывается со специальным распознающим компонентом мембраны клетки, возникает инвагинация мембраны и формируется пузырек, содержащий молекулы лекарства. Впоследствии лекарство выделяется из пузырька в клетку или транспортируется из клетки. Характерен для высокомолекулярных полипептидов.
Факторы, влияющие на перенос лекарств в организме:
1) физико-химические свойства вещества (гидро- и липофильность, ионизация, поляризуемость, размер молекул, концентрация)
2) структура барьеров переноса
3) кровоток
7. Перенос через мембраны лекарственных веществ с переменной ионизацией (уравнение ионизации Гендерсона-Гассельбальха). Принципы управления переносом.
Все ЛС — слабые кислоты или слабые основания, имеющие свои значения константы ионизации (рК). Если значение рН среды равно значению рК лекарства, то 50% его молекул будет находится в ионизированном и 50% в неионизированном состоянии и среда для лекарства будет нейтральной.
В кислой среде (рН меньше рК), там где имеется избыток протонов, слабая кислота будет находиться в недиссоциированной форме (R-COOH), т. е. будет связана с протоном – протонирована. Такая форма кислоты незаряжена и хорошо растворима в липидах. Если рН сместиться в щелочную сторону (т. е. рН станет больше рК), то кислота начнет диссоциировать и лишится протона, перейдя при этом в непротонированную форму, которая имеет заряд и плохо растворима в липидах.
В щелочной среде, там где имеется дефицит протонов, слабое основание будет находиться в недиссоциированной форме (R-NH2), т. е. будет непротонировано и лишено заряда. Такая форма основания хорошо растворима в липидах и быстро абсорбируется. В кислой среде имеется избыток протонов и слабое основание начнет диссоциировать, связывая при этом протоны и образуя протонированную, заряженную форму основания. Такая форма плохо растворима в липидах и слабо абсорбируется.
Следовательно, Абсорбция слабых кислот протекает преимущественно в кислой среде, а слабых оснований – в щелочной.
Особенности метаболизма слабых кислот (СК):
1) желудок: СК в кислом содержимом желудка неионизирована, а в щелочной среде тонкого кишечника она будет диссоциациировать и молекулы СК приобретут заряд. Поэтому, абсорбция слабых кислот будет наиболее интенсивной в желудке.
2) в крови среда достаточно щелочная и всосавшиеся молекулы СК перейдут в ионизированную форму. Фильтр клубочков почек пропускает как ионизированные, так и неионизированные молекулы, поэтому, несмотря на заряд молекулы, СК будут выводиться в первичную мочу
3) если моча щелочная, то кислота останется в ионизированной форме, не сможет реабсорбироваться обратно в кровоток и выделится с мочой; мочи кислая, то лекарство перейдет в неионизированную форму, которая легко реабсорбируется обратно в кровь.
Особенности метаболизма слабых оснований : противоположно СК (абсорбция лучше в кишечнике; в щелочной моче подвергаются реабсорбции)
Т. о., Чтобы ускорить выведение из организма слабой кислоты мочу необходимо ощелачивать, а чтобы ускорить выведение слабого основания ее необходимо подкислить (детоксикация по Попову).
Количественную зависимость процесса ионизации лекарства при различном рН среды позволяет получить уравнение Henderson — Hasselbach :
Где pKa соответствует значению pH, при котором концентрации ионизированной и неионизированной форм находятся в равновесии.
Уравнение Гендерсона-Гассельбаха позволяет оценить степень ионизации ЛС при данном значении рН и предсказать вероятность его проникновения через клеточную мембрану.
(1) Для разбавленной кислоты, A,
HA ↔ H+ + A — , где HA – концентрация неионизированной (протонированной) формы кислоты и A — — концентрация ионизированной (непротонированной) формы.
(2) Для слабого основания, B,
BH+ ↔ H+ + B, где BH+ — концентрация протонированной формы основания, B — концентрация непротонированной формы
Зная рН среды и рКа вещества, можно по вычисленному логарифму определить степень ионизации лекарства, а значит, и степень его всасывания из желудочно-кишечного тракта, реабсорбции или экскреции почками при разных значениях рН мочи и т. д.
8. Перенос лекарств в организме. Водная диффузия и диффузия в липидах (закон Фика). Активный транспорт.
Перенос ЛС в организме может осуществляться водной и липидной диффузией, активным транспортом, эндо — и пиноцитозом.
Особености перенос ЛС в организме водной диффузией:
1. Эпителиальные покровы (слизистые ЖКТ, полости рта и др.) – водная диффузия только очень малых молекул (метанол, ионы лития и т. д.)
2. Капилляры (кроме мозговых) – фильтрация веществ с молекулярной массой до 20-30 тыс. Да.
3. Капилляры мозга – в основном не имеют водных пор, за исключением областей гипофиза, эпифиза, зоны IV желудочка, хориоидного сплетения, медианного возвышения
4. Плацента – не имеет водных пор (хотя вопрос спорный).
5. Связывание ЛС с белками крови препятствует их выходу из кровяного русла, а значит, и водной диффузии
6. Диффузия в воде зависит от размеров молекул ЛС и водных пор
Особенности липидной диффузии:
1. Основной механизм переноса ЛС через клеточные мембраны
2. Определяется липофильностью диффундируемого вещества (т. е. коэффициентом распределения «масло/вода») и градиентом концентрации, может быть ограничена очень низкой растворимостью вещества в воде (что препятствует проникновению ЛС в водную фазу мембран)
3. Легко диффундируют неполярные соединения, трудно – ионы.
Любая диффузия (и водная, и в липидах) подчиняется закону диффузии Фика:
Скорость диффузии – количество переносимых в единицу времени молекул лекарства; С1 — концентрация вещества снаружи мембраны;С2 — концентрация вещества изнутри мембраны.
Следствие из закона Фика:
1) фильтрация ЛС тем выше, чем больше его концентрация в месте введения {S абсорбируемой поверхности в кишечнике больше, чем в желудке, поэтому абсорбция ЛС в кишечника более быстрая}
2) фильтрация ЛС тем выше, чем больше концентрация ЛС в месте введения
3) фильтрация ЛС тем выше, чем меньше толщина преодолеваемой биологической мембраны {толщина барьера в альвеолах легких значительно меньше, чем кожи, поэтому скорость абсорбции выше в легких}
Активный транспорт – перенос ЛC независимо от градиента концентрации с использованием энергии АТФ, характерен для гидрофильных полярных молекул, ряда неорганических ионов, сахаров, аминокислот, пиримидинов. Характеризуется: а) избирательностью к определенным соединениям б) возможностью конкуренции двух веществ за один транспортный механизм в) насыщаемостью при высоких концентрациях вещества г) возможностью транспорта против градиента концентрации д) затратой энергии.
9. Центральный постулат фармакокинетики концентрация лекарства в крови – основной параметр для управления терапевтическим эффектом. Задачи, решаемые на основании знания этого постулата.
Центральный постулат (догма) фармакокинетики: концентрация ЛВ в плазме крови детерминирует (количественно определяет) фармакологический эффект.
В большинстве случаев скорость всасывания, распределения, метаболизма и экскреции ЛС пропорциональна их концентрации в плазме крови (подчиняется закону действующих масс), поэтому зная ее возможно:
1) определить период полуэлиминации (для ЛС с кинетикой первого порядка)
2) объяснить длительность некоторых токсических эффектов ЛС (для ЛС в высоких дозах с кинетикой насыщения)
10. Биодоступность лекарств – определение, сущность, количественное выражение, детерминанты. Понятие о биодоступности
Биодоступность (F) – характеризует полноту и скорость всасывания ЛС при внесистемных путях введения — отражает количество неизмененного вещества, которое достигло системного кровотока, относительно исходной дозы препарата.
F составляет 100% для ЛС, которые вводят внутривенно. При введении другими путями F обычно меньше из-за неполной абсорбции и частичного метаболизма в периферических тканях. F равна 0, если ЛС не всасывается из просвета ЖКТ.
Для оценки F строят кривую зависимости концентрации ЛС в крови от времени после его введения внутривенно, а также после введения исследуемым путем. Это т. н. фармакокинетические кривые зависимости «время-концентрация». Путем интегрирования находят значения площади под фармакокинетической кривой и рассчитывают F как отношение:
![]() ≤ 1, где AUC – площадь под фармакокинетической кривой (Area Under Curve)
≤ 1, где AUC – площадь под фармакокинетической кривой (Area Under Curve)
Биодоступность > 70% считается высокой, ниже 30% — низкой.
Детерминанты биодоступности:
1) скорость всасывания
2) полнота всасывания — недостаточная абсорбция ЛС вследствие его очень высокой гидрофильности или липофильности, метаболизма бактериями кишечника при энтеральном введении и т. д.
3) пресистемная элиминация – при высокой биотрансформация в печени F ЛС низкая (нитроглицерин при пероральном введении).
4) лекарственная форма — сублингвальные таблетки и ректальные суппозитории помогают ЛС избежать пресистемной элиминации.
11. Распределение лекарств в организме. Отсеки, лиганды. Основные детерминанты распределения.
Распределение ЛС — процесс распространения ЛС по органам и тканям после того, как они поступят в системный кровоток.
Отсеки распределения:
1. Внеклеточное пространство (плазма, межклеточная жидкость)
2. Клетки (цитоплазма, мембрана органелл)
3. Жировая и костная ткань (депонирование ЛС)
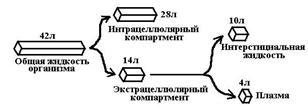 У человека массой 70 кг объемы жидких сред составляют в целом 42 л, тогда если:
У человека массой 70 кг объемы жидких сред составляют в целом 42 л, тогда если:
[ Vd=3-4 л, то все лекарство распределено в крови;
[ Vd= 4-14 л, то все лекарство распределено во внеклеточной жидкости;
[ Vd=14-42 л, то все лекарство приблизительно равномерно распределено в организме;
[ Vd>42 л, то все лекарство находится преимущественно во внеклеточном пространстве.
Молекулярные лиганды ЛС:
А) специфические и неспецифические рецепторы
Б) белки крови (альбумин, гликопротеин) и тканей
В) полисахариды соединительной ткани
Г) нуклеопротеиды (ДНК, РНК)
Детерминанты распределения:
· Природа ЛС — чем меньше размеры молекулы и липофильнее ЛС, тем быстрее и равномернее его распределение.
· Размер органов – чем больше размер органа, тем больше лекарственного средства может поступить в него без существенного изменения градиента концентраций
· Кровоток в органе — в хорошо перфузируемых тканях (мозг, сердце, почки) терапевтическая концентрация вещества создается значительно раньше, чем в тканях плохо перфузируемых (жировая, костная)
· Наличие гистогематических барьеров – ЛС легко проникают в ткани с плохо выраженным ГГБ
· Связывание лекарства с белками плазмы — чем больше связанная фракция ЛС, тем хуже его распределение в ткани, т. к. покидать капилляр могут лишь свободные молекулы.
· Депонирование лекарства в тканях — связывание ЛС с белками тканей способствует его накоплению в них, т. к. снижается концентрация свободного ЛС в периваскулярном пространстве и постоянно поддерживается высокий градиент концентраций между кровью и тканями.
Количественной характеристикой распределения лекарства является кажущийся объем распределения (Vd).
Кажущийся объем распределения Vd – это гипотетический объем жидкости, в котором может распределиться вся введенная доза лекарства, чтобы создалась концентрация, равная концентрации в плазме крови.
Vd равен отношению введенной дозы (общего количества лекарства в организме) к его концентрации в плазме крови:
 .
.
Чем больше кажущийся объем распределения, тем большая часть лекарств распределяется в ткани.
12. Константа элиминации, ее сущность, размерность, связь с другими фармакокинетическими параметрами.
Константа скорости элиминации (kel, мин-1) – показывает, какая часть ЛС элиминируется из организма в единицу времени Þ Kel = Aвыд/Аобщ, где Авыд – количество ЛС, выделяемое в ед. времени, Аобщ – общее количество ЛС в организме.
Значение kel обычно находят путем решения фармакокинетического уравнения, описывающего процесс элиминации лекарства из крови, поэтому kel называют модельным показателем кинетики. Непосредственного отношения к планированию режима дозирования kel не имеет, но ее значение используют для расчета других фармакокинетических параметров.
Константа элиминации прямо пропорциональна клиренсу и обратно пропорционально объему распределения (из определения клиренса): Kel=CL/Vd; = час-1/мин-1=доля в час.
13. Период полувыведения лекарств, его сущность, размерность, взаимосвязь с другими фармакокинетическими параметрами.
Период полуэлиминации (t½, мин) – это время, необходимое для снижения концентрации ЛС в крови ровно наполовину. При этом не играет роли каким путем достигается снижение концентрации – при помощи биотрансформации, экскреции или же за счет сочетания обоих процессов.
Период полуэлиминации определяют по формуле:
![]()
Период полувыведения – важнейший фармакокинетический параметр, позволяющий:
Б) определить время полной элиминации препарата
В) предсказать концентрацию ЛС в любой момент времени (для ЛС с кинетикой первого порядка)
14. Клиренс как главный параметр фармакокинетики для управления режимом дозирования. Его сущность, размерность и связь с другими фармакокинетическими показателями.
Клиренс (Cl, мл/мин) — объем крови, который очищается от ЛС за единицу времени.
Т. к. плазма (кровь) — «видимая» часть объема распределения, то клиренс – фракция объема распределения, из которой лекарство выделяется в единицу времени. Если обозначить общее количество лекарства в организме через Аобщ , а количество, которое выделилось через Авыд , то:
![]() С другой стороны, из определения объема распределения следует, что общее количество лекарства в организме составляет Аобщ=
Vd
´
C
Тер/плазма
. Подставляя это значение в формулу клиренса, мы получим:
С другой стороны, из определения объема распределения следует, что общее количество лекарства в организме составляет Аобщ=
Vd
´
C
Тер/плазма
. Подставляя это значение в формулу клиренса, мы получим:
![]() .
.
Таким образом, клиренс – отношение скорости выведения лекарственного средства к его концентрации в плазме крови.
В таком виде формулу клиренса используют для расчета поддерживающей дозы лекарства (D П ), т. е той дозы лекарственного средства, которая должна скомпенсировать потерю лекарства и поддержать его уровень на постоянном уровне:
Скорость введения = скорость выведения = Cl ´ C Тер (доза/мин)
D П = скорость введения ´ T (T — интервал, между приемом лекарства)
Клиренс аддитивен , т. е. элиминация вещества из организма может происходить с участием процессов, идущих в почках, легких, печени и других органах: Clсистемный = Clпочечн. + Clпечени + Clдр.
Клиренс связан С периодом полуэлиминации ЛС и объемом распределения : t1/2=0,7*Vd/Cl.
15. Доза. Виды доз. Единицы дозирования лекарственных средств. Цели дозирования лекарств, способы и варианты введения, интервал введения.
Действие ЛС на организм в большей степени определяется их дозой.
Доза — количество вещества, введенное в организм за один прием; выражается в весовых, объемных или условных (биологических) единицах.
Виды доз:
А) разовая доза – количество вещества на один прием
Б) суточная доза — количество препарата, назначаемое на сутки в один или несколько приемов
В) курсовая доза — общее количество препарата на курс лечения
Г) терапевтические дозы — дозы, в которых препарат используют с лечебными или профилактическими целями (пороговые, или минимальные действующие, средние терапевтические и высшие терапевтические дозы).
Д) токсические и смертельные дозы – дозы ЛВ, при которых они начинают оказывать выраженные токсические эффекты или вызывать смерть организма.
Е) загрузочная (вводная) доза – кол-во вводимого ЛС, которое заполняет весь объем распределения организма в действующей (терапевтической) концентрации: ВД = (Css * Vd)/F
Ж) поддерживающая доза – систематически вводимое количество ЛС, которое компенсирует потери ЛС с клиренсом: ПД = (Css * Cl * DT)/F
Единицы дозирования ЛС:
1) в граммах или долях грамма ЛС
2) количество ЛС в расчете на 1 Кг массы тела (например, 1 Мг/кг ) или на единицу поверхности тела (например, 1 Мг/м2 )
Цели дозирования ЛС:
1) определить количество ЛС, необходимое для того, чтобы вызвать нужный терапевтический эффект с определенной длительностью
2) избежать явлений интоксикации и побочных эффектов при введении ЛС
Способы введения ЛС : 1) энтерально 2) парентерально (см. в. 5)
Варианты введения ЛС :
А) непрерывный (путем длительных внутрисосудистых инфузий ЛС капельно или через автоматические дозаторы). При непрерывном введении ЛС его концентрация в организме изменяется плавно и не подвергается значительным колебаниям
Б) прерывистое введение (инъекционным или неинъекционным способами) — введение лекарства через определенные промежутки времени (интервалы дозирования). При прерывистом введении ЛС его концентрация в организме непрерывно колеблется. После приема определенной дозы она вначале повышается, а затем постепенно снижается, достигая минимальных значений перед очередным введением лекарства. Колебания концентрации тем значительнее, чем больше вводимая доза лекарства и интервал между введениями.
Интервал введения – интервал между вводимыми дозами, обеспечивающий поддержание терапевтической концентрации вещества в крови.
16. Введение лекарств с постоянной скоростью. Кинетика концентрации препарата в крови. Стационарная концентрация препарата в крови (Css ), время ее достижения, расчет и управление ею.
 Особенность введения ЛС с постоянной скоростью — плавное изменение его концентрации в крови при введении, при этом:
Особенность введения ЛС с постоянной скоростью — плавное изменение его концентрации в крови при введении, при этом:
1) время достижения стационарной концентрации лекарства составляет 4-5t½ и не зависит от скорости инфузии (величины вводимой дозы)
2) при увеличении скорости инфузии (вводимой дозы) величина СSS также увеличивается в пропорциональное число раз
3) элиминация лекарства из организма после прекращения инфузии занимает 4-5t½.
С Ss – равновесная стационарная концентрация – концентрация ЛС, достигаемая при скорости введения равной скорости выведения, поэтому:
![]() (из определения клиренса)
(из определения клиренса)
За каждый последующий период полувыведения концентрация ЛС прирастает на половину от оставшейся концентрации. Все ЛС, подчиняющиеся закону элиминации первого порядка, Будут достигать Css через 4-5 периодов полувыведения.
Подходы к управлению уровнем С Ss : изменить вводимую дозу ЛС или интервал введения
17. Прерывистое введение лекарств. Кинетика концентрации препарата в крови, терапевтический и токсический диапазон концентраций. Расчет стационарной концентрации (C Ss ), границ ее колебаний и управление ею. Адекватный интервал введения дискретных доз.
 Колебания концентрации ЛС в плазме крови: 1 — при постоянном внутривенном капельном введении; 2 -при дробном введении той же суточной дозы с интервалом 8 ч;3 - при введении суточной дозы с интервалом 24 ч.
Колебания концентрации ЛС в плазме крови: 1 — при постоянном внутривенном капельном введении; 2 -при дробном введении той же суточной дозы с интервалом 8 ч;3 - при введении суточной дозы с интервалом 24 ч.
Прерывистое введение ЛС – введение определенного количества ЛС через некоторые промежутки времени.
Равновесная стационарная концентрация достигается через 4-5 периодов полуэлиминации, время ее достижения не зависит от дозы (в начале, когда уровень концентрации ЛС невысок, скорость его элиминации также невысока; по мере увеличения количества вещества в организме нарастает и скорость его элиминации, поэтому рано или поздно наступит такой момент, когда возросшая скорость элиминации уравновесит вводимую дозу ЛС и дальнейший рост концентрации прекратиться)
Css прямо пропорциональна дозе ЛС и обратно пропорциональна интервалу введения и клиренсу ЛС.
Границы колебаний Css: ![]() ; Cssmin = Cssmax × (1 – эл. фр.). Колебания концентрации ЛС пропорциональны T/t1/2.
; Cssmin = Cssmax × (1 – эл. фр.). Колебания концентрации ЛС пропорциональны T/t1/2.
Терапевтический диапазон (коридор безопасности, терапевтическое окно) – это интервал концентраций от минимальной терапевтической до вызывающей появление первых признаков побочных действий.
Токсический диапазон – интервал концентрации от высшей терапевтической до смертельной.
Адекватный режим введения дискретных доз : такой режим введения, при котором флюктуация концентрации препарата в крови укладывается в терапевтический диапазон. Для определения адекватного режима введения ЛС необходимо рассчитать. Разница между Cssmax и Cssmin при этом не должна превысить 2Css.
Управление колебаниями Css :
Размах колебаний Css прямо пропорционален дозе ЛС и обратно пропорционален интервалу его введения.
1. Изменить дозу ЛС : при увеличении дозы ЛС диапазон колебаний его Css пропорционально увеличивается
2. Изменить интервал введения ЛС : при увеличении интервала введения ЛС диапазон колебаний его Css пропорционально уменьшается
3. Одновременно изменить дозу и интервал введения
18. Вводная (загрузочная) доза. Терапевтический смысл, расчет по фармакокинетическим параметрам, условия и ограничения ее использования.
Вводная (загрузочная) доза – доза, вводимая за один прием и заполняющая весь объем распределения в действующей терапевтической концентрации. ВД=(Css*Vd)/F ; =мг/л, =л/кг
Терапевтический смысл : вводная доза быстро обеспечивает действующую терапевтическую концентрацию ЛС в крови, что позволяет, например, быстро купировать приступ БА, аритмии и т. д.
Вводная доза может быть введена за один раз лишь тогда, когда Игнорируется процесс распределения вещества
Ограничение использования ВД : если распределение ЛС происходит Значительно медленнее, чем его поступление в кровь , введение сразу всей загрузочной дозы (особенно внутривенно) создаст концентрацию значительно выше терапевтической и обусловит возникновение токсических эффектов. Условие использования ВД : поэтому введение нагрузочных доз Всегда должно быть медленным или дробным .
19. Поддерживающие дозы, их терапевтический смысл и расчет для оптимального режима дозирования.
Поддерживающая доза – доза ЛС, вводимая систематически, которая заполняет объем клиренса, т. е. тот фрагмент Vd, который очищается от ЛС за интервал DT: ПД=(Css*Cl*DT)/F.
Терапевтический смысл : ПД компенсирует потери с клиренсом за интервал между введениями препарата.
Расчет для оптимального дозирования ЛС (для быстрого купирования приступа):
1. Рассчитываем ВД: ВД=(Css*Vd)/F
2. Выбираем интервал введения DT (обычно большинство ЛС назначается с интервалом, близким к t1/2) и рассчитываем ПД: ПД=(Css*Cl*DT)/F
3. Проверяем, не выходят ли колебания ЛС в крови за пределы терапевтического диапазона путем расчета Cssmax и Сssmin: ![]() ; Cssmin = Cssmax × (1 – эл. фр.). Разница между Cssmax и Сssmin не должна превышать двух Css.
; Cssmin = Cssmax × (1 – эл. фр.). Разница между Cssmax и Сssmin не должна превышать двух Css.
Элиминируемая фракция находится по графику (см. в.16) или по формуле: ![]()
4. Если при выбранном нами интервале введения ЛС его колебания выходят за пределы терапевтического диапазона, меняем DT и повторяем расчет (пункт 2 – пункт 4)
NB! Если ЛС не предназначено для купирования неотложных состояний или принимается в таблетках, ВД не рассчитывается.
20. Индивидуальные, возрастные и половые различия фармакокинетики лекарств. Поправки для расчета индивидуальных значений объема распределения лекарств.
1. Возрастные различия фармакокинеткики лекарств.
|
1. Роговой слой кожи тоньше, поэтому при накожном применении ЛС всасываются лучше. Абсорбция ЛС при ректальном применении также лучше. 2. Объем жидкости в организме детей 70-80%, тогда как у взрослых только »60%, поэтому Vd гидрофильных ЛС у них больше и требуются более высокие дозы. 3. У новорожденного уровень альбумина в плазме ниже, чем у взрослых, поэтому связывание ЛС с белком у них менее интенсивное 4. У новорожденных низкая интенсивность систем цитохрома Р450 и конъюгирующих ферментов, но высокая активность метилирующих систем. 5. Скорость клубочковой фильтрации в почках детей до 6 мес составляет 30-40% скорости взрослых, поэтому почечная эксркеция лекарств снижена. |
1. Отмечается снижение концентрации альбумина в плазме крови и фракция лекарства, связанная с белком 2. Уменьшается содержание воды в организме с 60% до 45%, поэтому увеличивается кумуляция липофильных лекарств. 3. Скорость клубочковой фильтрации может падать до 50-60% от скорости зрелого пациента, поэтому почечная элиминация лекарств резко ограничивается. |
2. Половые различия в действии лекарств . Для женщин характерна меньшая масса тела, чем для мужчин, поэтому и величина доз лекарства для них должна находиться, как правило, у нижней границы диапазона терапевтических доз.
3. Патологические состояния организма и действие лекарств
А) заболевания печени: F ЛС из-за выключения пресистемного метаболизма, фракция несвязанного ЛС из-за недостатка синтеза альбуминов, пролонгируются эффекты ЛС из-за ¯ их биотрансформации.
Б) патология почек: замедляется элиминация ЛС, которые выводятся через почки
4. Генетические факторы – дефицит тех или иных ферментов метаболизма ЛС может способствовать пролонгированию их действия (псевдохолинэстераза и т. д.)
Поправки для расчета индивидуальных значений объема распределения ЛС:
А) при ожирении липофобные ЛС не растворимо в жировой ткани Þ необходимо вычислить идеальный вес по росту (формула Брока: идеальный вес = рост (в см) — 100) и пересчитать Vd на идеальный вес по росту.
Б) при отеках нужно вычислить избыточный объём воды = избыточный вес – идеальный, Vd надо увеличивать на литр каждого избыточного килограмма воды.
Зависимость основных фармакокинетических параметров от различных факторов:
1. Всасывание ЛС: при возраста ¯ абсорбция ЛС, его метаболизм в ходе пресистемной элиминации, изменяется биодоступность ЛС.
2. Объем распределения Vd: ¯ с возрастом и при ожирении, при отеках
3. Период полувыведения: изменяется с возрастом и при ожирении (т. к. уменьшается Vd)
4. Клиренс: определяется функциональным состоянием почек и печени
21. Почечный клиренс лекарств, механизмы, их количественные и качественные характеристики.
Почечный клиренс — это мера объема плазмы крови, которая очищается от лекарственного вещества в единицу времени почками: Cl (мл/мин) = U × V/P, где U — концентрация ЛС в мл мочи, V – объем мочи, выделяемой в мин и P = концентрация ЛС в мл плазмы.
Механизмы почечного клиренса и их характеристика:
1. Фильтрация : ЛС, выделяемое Только фильтрацией {инсулин} будет иметь клиренс, равный СКФ (125-130 мл/мин)
Определяется: почечным кровотоком, несвязанной фракцией ЛС и фильтрационной способностью почек.
Большинство препаратов имеет низкие молекулярные массы и поэтому свободно фильтруется от плазмы в клубочке.
2. Активная секреция : ЛС, выделяемое Фильтрацией и полной секрецией {парааминогиппуриевая кислота}, будет иметь клиренс, равный почечному плазменному клиренсу (650 мл/мин)
Почечный каналец содержит две транспортных системы , которые могут выделить препараты в ультрафильтрат, одна для органических кислот и другая для органических оснований. Эти системы требуют энергии для активного транспорта против градиента концентраций; они – место конкуренции за переносчика одних лекарственных веществ с другими.
Определяется: максимальной скоростью секреции, объемом мочи
3. Реабсорбция : значения клиренса между 130 и 650 мл/мин предполагают, что ЛС Фильтруется, выделяется, и частично повторно реабсорбируется
Реабсорбция происходит на протяжении всего почечного канала и зависит от полярности ЛС, реабсорбируются неполярные, липофильные.
Определяется: величиной рН первичной и ионизацией ЛС
Ряд таких показателей как Возраст, совместное употребление нескольких лекарственных препаратов, болезни значительно влияют на почечный клиренс:
А) почечная недостаточность ® уменьшение клиренса ЛС® высокий уровень ЛС в крови
Б) гломерулонефрит ® потеря сывороточного белка, который обычно был доступен и связывал ЛС ® увеличение уровня свободной фракции ЛС в плазме
22. Факторы, влияющие на почечный клиренс лекарств. Зависимость клиренса от физико-химических свойств лекарственных средств.
Факторы, влияющие на почечный Cl :
А) гломерулярная фильтрация
Б) скорость почечного кровотока
В) максимальная скорость секреции
Г) объём мочи
Д) фракция несвязанная в крови
Зависимость почечного клиренса от физико-химических свойств ЛВ:
Общие закономерности: 1) полярные ЛС не реабсорбируются, неполярные – реабсорбируются 2) ионные ЛС секретируются, не ионные – не секретируются.
I. Неполярные неионогенные вещества: фильтруются только в несвязанных формах, не секретируются, реабсорбируются
Почечный клиренс мал и определяется: а) фракцией ЛС, несвязанной в крови б) объемом мочи
II. Полярные неионогенные вещества: фильтруются в несвязанной форме, не секретируют, не реабсорбируются
Почечный клиренс высокий, определяется: а) фракцией ЛС, несвязанной в крови б) скоростью гломерулярной фильтрации
III. Ионизированные в моче неполярные в неионной форме: фильтруются, активно секретируются, неполярные реабсорбируются
Почечный клиренс определяется: а) фракцией ЛС, несвязанной в крови б) фракцией ЛС, ионизированной в моче в) объемом мочи
IV. Ионизированные в моче полярные в неионизированном виде: фильтруются, активно секретируются, не реабсорбируются
Почечный клиренс определяется: а) почечным кровотоком и скоростью гломерулярной фильтрации б) максимальной скоростью секреции
23. Печеночный клиренс лекарств, его детерминанты и ограничения. Энтерогепатический цикл лекарственных средств.
Механизмы печеночного клиренса:
1) метаболизм (биотрансформация) путем окисления, восстановления, алкилирования, гидролиза, коньюгации и т. д.
Основная стратегия метаболизма ксенобиотиков: неполярные вещества ® полярные (гидрофильные) метаболиты, выводимые с мочой.
2) секреция (выведение нетрансформированных веществ в желчь)
Только полярные вещества с молекулярной массой > 250 активной транспортируются в желчь (органические кислоты, основания).
Детерминанты печеночного клиренса:
А) Скорость кровотока в печени
Б) Максимальная скорость экскреции или метаболических превращений
В) Km – константа Михаэлиса
Г) Несвязанная с белком фракция
Ограничения печеночного клиренса:
1. Если Vmax/Km велико → Cl печ = скорости кровотока в печени
2. Если Vmax/Km средние величины → Cl = сумма всех факторов
3. Если Vmax/Km мало → Cl печ мал, ограничен
Энтерогепатический цикл ЛС — Ряд препаратов и продуктов их превращения в значительном количестве выводится с желчью в кишечник, откуда частично выводится с экскрементами, а частично — Повторно всасывается в кровь , вновь попадает в печень и выводится в кишечник.
Печеночная элиминация препаратов может быть значительно изменена Болезнью печени, возрастом, диетой, генетикой, продолжительность назначения лекарственных средств (например, вследствие индукция печеночных ферментов), и других факторов.
24. Факторы, изменяющие клиренс лекарственных веществ.
1. Взаимодействия ЛС на уровне: почечной секреции, биохимической трансформации, явлений ферментативной индукции
2. Болезни почек: нарушения кровотока, острые и хронические поражения почек, исходы длительных почечных заболеваний
3. Болезни печени: алкогольный цирроз, первичный цирроз, гепатиты, гепатомы
4. Болезни ЖКТ и эндокринных органов
5. Индивидуальная непереносимость {отсутствие ферментов ацетилирования – непереносимость аспирина}
25. Коррекция лекарственной терапии при заболеваниях печени и почек. Общие подходы. Коррекция режима дозирования под контролем общего клиренса препарата.
1. Отменить препараты, которые не являются необходимыми
2. При заболеваниях почек использовать препараты, выделяющиеся с печенью и наоборот.
3. Снизить дозу или увеличить интервал между введениями
4. Тщательный мониторинг за побочными и токсическими эффектами
5. При отсутствии фармакологического эффекта повышать дозу необходимо медленно и под контролем фармакологических и токсических эффектов
6. При возможности определить концентрацию вещества в плазме и корригировать терапию по Сl препарата индивидуально
7. Использовать косвенный способ оценки Cl.
Коррекция режима дозирования под контролем общего клиренса препарата:
Коррекция дозы: Динд.=Дтипичн.×Clинд./Clтипичн.
При непрерывном внутривенном введении препарата: Скорость введения индивидуальная = Скорость введения типичная × Cl инд. / Cl типичн.
При прерывистом введении: 1) изменить дозу 2) изменить интервал 3) изменить оба параметра. Например, при уменьшении клиренса на 50% можно уменьшить на 50% дозу и сохранить интервал или увеличить в два раза интервал и сохранить дозу. Предпочтительно уменьшать дозу и сохранять интервал введения.
26. Коррекция режима дозирования под контролем остаточной функции почек.
Клиренс креатинина – важнейший количественный индикатор функции почек, на основе которого можно скоректировать режим дозирования
Нам известно:
А) остаточная функция почек, определяющаяся клиренсом креатинина у данного больного Clкр/больного
Б) общий клиренс данного ЛС (СlЛС/общий) и доля почечного клиренса ЛС в общем клиренсе
В) нормальный клиренс креатинина Clкр/норма по нормограмме
3) Css и F для данного ЛС (из справочника)
Найти : дозу ЛС для данного больного
ClЛС/почечный норма = ClЛС/общий Х долю почечного клиренса ЛС в общем клиренсе
СlЛС/почечный больного = Clкр/больного / Сlкр/норма * ClЛС/почечный норма
ClЛС/не почечный норма = ClЛС/общий – ClЛС/почечный норма
ClЛС/общий больного = СlЛС/почечный больного + ClЛС/не почечный норма
Доза данного ЛС внутрь при нормальной функции почек равна: ПДнорма = Css X Cl / F
Доза данного ЛС внутрь для нашего больного равна: ПДбольного = ПДнорма Х СlЛС/общий больного / СlЛС/общий
Ответ : ПДбольного
27. Коррекция лекарственной терапии при поражении печени и других патологических состояниях.
Заболевания печени могут снижать клиренс и удлинять период полувыведения многих ЛС. Однако у некоторых препаратов, которые элиминируются печенью, не происходит изменения этих показателей при нарушениях функции печени, поэтому Заболевания печени не всегда влияют на собственный печеночный клиренс . В настоящее время нет надежного маркера, который можно было бы использовать для предсказания печеночного клиренса подобного клиренсу креатинина.
Коррекцию режима дозирования при заболевании почек см. выше в в.26, общие принципы коррекции – в.25.
28. Стратегия индивидуальной лекарственной терапии.
Признание важной роли концентрации как связующего звена фармакокинетики и фармакодинамики способствует созданию стратегии целевой концентрации — оптимизации дозы у данного больного на основе измерения концентрации ЛС. Она складывается из следующих этапов:
1. Выбор целевой концентрации
2. Расчет Vd и Cl на основе типовых значений и внесения поправок с учетом таких факторов как масса тела и функция почек.
3. Ввод загрузочной дозы или поддерживающей дозы, рассчитанных с учетом значений TC, Vd и Cl.
4. Регистрация реакции больного и определение концентрации ЛС
5. Пересмотр Vd и Cl на основе результатов измерения концентрации.
6. Повтор шагов 3-6 с целью подбора необходимой для оптимальной реакции на лекарство поддерживающей дозы.
29. Биотрансформация лекарственных средств, ее биологический смысл, основная направленность и влияние на активность лекарств. Основные фазы метаболических превращений лекарств в организме.
Биотрансформация ЛС – химические превращения ЛС в организме.
Биологический смысл биотрансформации ЛС : создание субстрата, удобного для последующей утилизации (в качестве энергетического или пластического материала) или в ускорении выведения ЛС из организма.
Основная направленность метаболических превращений ЛС : неполярные ЛС → полярные (гидрофильные) метаболиты, выводимые с мочой.
Выделяют две фазы метаболических реакций ЛС:
1) Метаболическая трансформация (несинтетические реакции, фаза 1) — превращение веществ за счет микросомального и внемикросомального окисления, восстановления и гидролиза
2) конъюгация (синтетические реакции, фаза 2) — биосинтетический процесс, сопровождающийся присоединением к лекарственному веществу или его метаболитам ряда химических группировок или молекул эндогенных соединений путем а) образования глюкуронидов б) эфиров глицерина в) сульфоэфиров г) ацетилирования д) метилирования
Влияние биотрансформации на фармакологическую активность ЛС:
1) чаще всего метаболиты биотрансформации не обладают фармакологической активностью или их активность снижена по сравнению с исходным веществом
2) в некоторых случаях метаболиты могут сохранять активность и даже превосходить по активности исходное вещество (кодеин метаболизируется до более фармакологически активного морфина)
3) иногда в ходе биотрансформации образуются токсичные вещества (метаболиты изониазида, лидокаина)
4) иногда в ходе биотрансформации образуются метаболиты с противоположными фармакологическими свойствами (метаболиты неселективных агонистов b2- адренорецепторов обладают свойствами блокаторов этих рецепторов)
5) ряд веществ является пролекарствами, которые исходно не дают фармакологических эффектов, но в ходе биотрансформации преобразуются в БАВ (неактивная L-допа, проникая через ГЭБ, превращается в мозге в активный дофамин, при этом нет системных эффектов дофамина).
30. Клиническое значение биотрансформации лекарств. Влияние пола, возраста, массы тела, экологических факторов, курения, алкоголя на биотрансформацию лекарств.
Клиническое значение биотрансформации ЛС : т. к. доза и частота приема, необходимые для достижения эффективной концентрации в крови и тканях, могут варьировать у больных из-за индивидуальных различий в распределении, скорости метаболизма и элиминации ЛС, важен их учет в клинической практике.
Влияние на биотрансформацию ЛС различных факторов:
А) Функциональное состояние печени : при ее заболеваниях клиренс ЛС обычно уменьшается, а период полуэлиминации возрастает.
Б) Влияние факторов среды : курение способствует индукции цитохрома P450, в результате чего ускоряется метаболизм ЛС в ходе микросомального окисления
В) У вегетарианцев биотрансформация ЛС замедлена
Г) у пожилых и молодых пациентов характерна повышенная чувствительность к фармакологическому или токсическому действию ЛС (у лиц пожилого возраста и у детей до 6 мес активность микросомального окисления снижена)
Д) у мужчин метаболизм некоторых ЛС происходит быстрее, чем у женщин, т. к. андрогены стимулируют синтез микросомальных ферментов печени {этанол}
Е) Высокое содержание в пище белков и интенсивная физическая нагрузка : ускорение метаболизма ЛС.
Ж) Алкоголь и ожирение замедляют метаболизм ЛС
31. Метаболическое взаимодействие лекарств. Болезни, влияющие на их биотрансформацию.
Метаболическое взаимодействие ЛС:
1) индукция ферментов метаболизма ЛС – абсолютное увеличение их количества и активности вследствие воздействия на них определенных ЛС. Индукция ведет к ускорению метаболизма ЛС и (как правило, но не всегда) к снижению их фармакологической активности (рифампицин, барбитураты – индукторы цитохрома P450)
2) ингибирование ферментов метаболизма ЛС – угнетение активности ферментов метаболизма под действием некоторых ксенобиотиков:
А) конкурентное метаболическое взаимодействие – ЛС с высоким аффинитетом к определенным ферментам снижают метаболизм ЛС с более низким аффинитетом к этим ферментам (верапамил)
Б) связывание с геном, индуцирующим синтез определенных изоферментов цитохрома P450 (цимедин)
В) прямая инактивация изоферментов цитохрома P450 (флавоноиды)
Болезни, влияющие на метаболизм ЛС:
А) болезни почек (нарушение почечного кровотока, острые и хронические заболевания почек, исходы длительных почечных заболеваний)
Б) болезни печени (первичный и алкогольный циррозы, гепатиты, гепатомы)
В) болезни ЖКТ и эндокринных органов
В) индивидуальная непереносимость некоторых ЛС (отсутствие ферментов ацетилирования – непереносимость аспирина)
32. Пути и механизмы выведения лекарств из организма. Возможности управления выведением лекарств.
Пути и механизмы выведения ЛС: элиминация ЛС печенью и почками и некоторыми другими органами:
А) почками путем фильтрации, секреции, реабсорбции
Б) печенью путем биотрансформации, экскреции с желчью
В) через легкие, слюну, пот, молоко и т. д. путем секреции, испарения
Возможности управления процессами выведения ЛС:
1. управление pH: в щелочной моче повышается выведение кислых соединений, в кислой – выведение основных соединений
2. применение желчегонных препаратов (холензим, аллохол)
3. гемодиализ, перитонеальный диализ, гемосорбция, лимфосорбция
4. форсированный диурез (в/в NaCl или глюкоза для водной нагрузки + фуросемид или маннитол)
5. промывание желудка, применение клизм
33. Концепция рецепторов в фармакологии, молекулярная природа рецепторов, сигнальные механизмы действия лекарств (типы трансмембранной сигнализации и вторичные посредники).
Рецепторы – Молекулярные компоненты клетки или организма, которые взаимодействуют с ЛС и индуцируют ряд биохимических событий, ведущих к развитию фармакологического эффекта.
Концепция рецепторов в фармакологии:
1. Рецепторы детерминируют количественные закономерности действия ЛС
2. Рецепторы ответственны за селективность действия ЛС
3. Рецепторы посредники действия фармакологических антагонистов
Концепция рецепторов — основа целенаправленного применения лекарственных средств, влияющих на регуляторные, биохимические процессы и коммуникации.
Молекулярная природа рецепторов:
1. регуляторные белки, посредники действия различных химических сигналов: нейромедиаторов, гормонов, аутокоидов
2. ферменты и трансмембранные белки переносчики (Na+, K+ АТФаза)
3. структурные белки (тубулин, белки цитоскелета, клеточная поверхность)
4. ядерные белки и нуклеиновые кислоты
Сигнальные механизмы действия лекарств:
1) проникновение растворимых в липидах лигандов через мембрану и их действие на внутриклеточные рецепторы.
2) сигнальная молекула связывается с внеклеточным доменом трансмембранного белка и активирует ферментативную активность его цитоплазматического домена.
3) сигнальная молекула связывается с ионным каналом и регулирует его открытие.
4) сигнальная молекула связывается с рецептором на поверхности клетки, который сопряжен с эффекторным ферментом посредством G-белка. G-белок активирует вторичный посредник.
Типы трансмембранной сигнализации:
А) через 1-TMS-рецепторы, обладающие и не обладающие тирозинкиназной активностью
Б) через 7-ТMS-рецепторы, связанные с G-белком
В) через ионные каналы (лиганд-зависимые, потенциал-зависимые, щелевые контакты)
Вторичные посредники : цАМФ, ионы Ca2+, ДАГ, ИФ3.
34. Физико-химические и химические механизмы действия лекарственных веществ.
А) Физико-химическое взаимодействие с биосубстратом – неэлектролитное действие.
Основные фармакологические эффекты: 1) наркотическое 2) обще депрессивное 3) парализующее 4) местно раздражающее 5) мембранолитическое действия.
Химическая природа веществ: химически инертные углеводороды, эфиры, спирты, альдегиды, барбитураты, газовые наркотические средства
Механизм действия – обратимое деструирование мембран.
Б) Химический (молекулярно-биохимический) механизм действия лекарственных средств.
Основные типы химического взаимодействия с биосубстратом:
- Слабые (нековалентные, обратимые взаимодействия) (водородные, ионные, монодипольные, гидрофобные).
- Ковалентные связи (алкилирование).
Значение нековалентных взаимодействий ЛС : действие неспецифично, не зависит от химического строения вещества.
Значение ковалентных взаимодействий ЛС : действие специфично, критически зависит от химических строения, реализиуется посредством влияния на рецепторы.
35. Термины и понятия количественной фармакологии: эффект, эффективность, активность, агонист (полный, частичный), антагонист. Клиническое различие понятий активность и эффективность лекарств.
 Эффект (ответ)
– количественный выход реакции взаимодействия клетки, органа, системы или организма с фармакологическим агентом.
Эффект (ответ)
– количественный выход реакции взаимодействия клетки, органа, системы или организма с фармакологическим агентом.
Эффективность – мера реакции по оси эффекта – величина отклика биологической системы на фармакологическое воздействие; Это способность ЛС оказывать максимально возможное для него действие . Т. е. фактически это максимальная величина эффекта, которую можно достигнуть при введении данного лекарства. Численно характеризуется величиной Еmax. Чем выше Еmax, тем выше эффективность лекарства
Активность – мера чувствительности к ЛС по оси концентраций, характеризует аффинность (сродство лиганда к рецептору), Показывает, какая доза (концентрация) ЛС способна вызвать развитие стандартного эффекта, равного 50% от максимально возможного для этого лекарства . Численно характеризуется величиной ЕС50 или ED50. Чем выше активность ЛС, тем меньшая его доза требуется для воспроизведения терапевтического эффекта.
Эффективность: 1=2>3
Активность: 1>3>2
В клинической деятельности важнее знать эффективность, а не активность, т. к. нас больше интересует способность ЛС вызывать определенное действие в организме.
Агонист – лиганд, который связывается с рецептором и вызывает биологическую реакция, срабатывание физиологической системы. Полный агонист – максимальный отклик, Частичный – вызывают меньшую реакцию даже при оккупации всех рецепторов.
Антагонист — лиганды занимающие рецепторы или изменяющие их таким образом, что они утрачивают способность взаимодействовать с другими лигандами, но сами не вызывающие биологической реакции (блокируют действие агонистов).
 Конкурентные антагонисты
— взаимодействуют с рецепторами обратимо и тем самым конкурируют с агонистами. Увеличение концентрации агониста может полностью устранить эффект антагониста. Конкурентный антагонист сдвигает кривую «доза-эффект» для агониста, увеличивает EC50, не влияет на Emax.
Конкурентные антагонисты
— взаимодействуют с рецепторами обратимо и тем самым конкурируют с агонистами. Увеличение концентрации агониста может полностью устранить эффект антагониста. Конкурентный антагонист сдвигает кривую «доза-эффект» для агониста, увеличивает EC50, не влияет на Emax.
Неконкурентные антагонисты — необратимо изменяют сродство рецепторов к агонисту, связывание часто происходит не с активным участком рецептора, увеличение концентрации агониста не устраняет действие антагониста. Неконкурентный антагонист снижает Emax, не изменяет EC50, кривая «доза-эффект» сжимается относительно вертикальной оси.
36. Количественные закономерности действия лекарств. Закон уменьшения отклика биологических систем. Модель Кларка и ее следствия. Общий вид зависимости концентрация – эффект в нормальных и логнормальных координатах.
Модель Кларка-Ариенса:
1. Взаимодействие между лигандом (L) и рецептором (R) обратимы.
2. Все рецепторы для данного лиганда – эквивалентны и независимы (их насыщение не влияет на другие рецепторы).
3. Эффект прямо пропорционален числу занятых рецепторов.
4. Лиганд существует в двух состояниях: свободном и связанном с рецептором.
А) ![]() , где Kd – константа равновесия, Ke – внутренняя активность.
, где Kd – константа равновесия, Ke – внутренняя активность.
Б) Т. к. при возрастании количества лигандов в какой-то момент времени все рецепторы окажутся заняты, то максимально возможное количество образованных комплексов лиганд-рецептор описывается формулой:
= [R] × ![]() (1)
(1)
Эффект определяется вероятностью активации рецептора при связывании с лигандом, т. е. его внутренней активностью (Ке), поэтому E = Ke×. При этом эффект максимален при Ке=1 и минимален и Ке=0. Естественно, что максимальный эффект описывается соотношением Emax = Ke×, где – общее число рецепторов для данного лиганда
Эффект зависит и от концентрации лиганда на рецепторах [С], поэтому
E = Emax ![]() (2)
(2)
Из приведенных соотношений вытекает, что EC50=Kd
![]()
Emax – максимальный эффект, Bmax – максимальное число связанных рецепторов, EC50 – концентрация ЛС, при которой возникает эффект, равный половине от максимального, Kd – константа диссоциации вещества от рецептора, при которой связано 50% рецепторов.
Закону убывания отклика соответствует параболическая зависимость «концентрация – эффективность». Ответ на малые дозы ЛС обычно возрастает прямо пропорционально дозе . Однако при увеличении дозы прирост ответной реакции снижается и в конечном счете может быть достигнута доза, при которой не происходит дальнейшего увеличения ответа (за счет оккупации всех рецепторов для данного лиганда).
37. Изменение эффекта лекарств. Градуальная и квантовая оценка эффекта, сущность и клинические приложения. Меры количественной оценки активности и эффективности лекарств в экспериментальной и клинической практике.
Все фармакологические эффекты можно условно разделить на две категории:
А) Градуальные (непрерывные, интегральные) эффекты – такие эффекты ЛС, которые могут быть измерены количественно { действие гипотензивных ЛС – по уровню АД}. Описываются градуальной «кривой доза-эффект» (см. в. 36), на основе которой можно оценить: 1) индивидуальную чувствительность к ЛС 2) активность ЛС 3) максимальную эффективность ЛС
Б) Квантовые эффекты – такие эффекты ЛС, которые являются дискретной величиной, качественным признаком, т. е. описываются всего лишь несколькими вариантами состояний {головная боль после приема анальгетика или есть, или нет}. Описывается квантовой кривой доза-эффект, где отмечают зависимость проявления эффекта в популяции от величины принимаемой дозы ЛС. График зависимости доза-эффект при этом имеет куполообразный вид и идентичен Гауссовой кривой нормального распределения. На основе квантовой кривой можно: 1) оценить популяционную чувствительность ЛС 2) отметить наличие эффекта при данной дозе 3) выбрать среднюю терапевтическую дозу.
Различия между градуальной и квантовой характеристикой «доза-эффект»:
Количественная оценка активности и эффективности ЛС проводится на основе построения кривых «доза-эффект» и их последующей оценке (см. в.35)
38. Виды действия лекарственных средств. Изменение действия лекарств при их повторном введении.
Виды действия ЛС:
1. Местное действие – действие вещества, возникающее на месте его приложения (анестетик – на слизистую оболочку)
2. Резорбтивное (системное) действие – действие вещества, развивающееся после его всасывания, поступления в общий кровоток, а затем в ткани. Зависит от путей введения ЛС и их способности проникать через биологические барьеры.
Как при местном, так и резорбтивном действии лекарственные средства могут оказывать либо Прямое , либо Рефлекторное влияние:
А) прямое влияние — непосредственный контакт с органом-мишенью (адреналин на сердце).
Б) рефлекторное – изменение функции органов или нервных центров путем влияния на экстеро — и интерорецепторы (горчичники при патологии органов дыхания рефлекторно улучшают их трофику)
Изменения действия ЛС при их повторном введении:
1. Кумуляция – увеличение эффекта вследствие накопления в организме ЛС:
а) материальная кумуляция — накопление действующего вещества в организме {сердечные гликозиды}
б) функциональная кумуляция – нарастающие изменения функции систем организма {изменения функции ЦНС при хроническом алкоголизме}.
2. Толерантность (привыкание) — Снижение ответной реакции организма на повторные введения ЛС; для того, чтобы восстановить реакцию на ЛС, его приходится вводить во все бóльших и бóльших дозах {диазепам}:
А) истинная толерантность – наблюдается как при энтеральном, так и при парентеральном введении ЛС, не зависит от степени его всасывания в кровоток. В ее основе — фармакодинамические механизмы привыкания:
1) десенситизация – снижение чувствительности рецептора к лекарственному средству {b-адреномиметики при длительном применении приводят к фосфорилированию b-адренорецепторов, которые не способны ответить на b-адреномиметики}
2) Down-регуляция – снижение числа рецепторов к лекарственному средству {при повторных введениях наркотических анальгетиков количество опиоидных рецепторов снижается и требуются все бóльшие и бóльшие дозы лекарства, чтобы вызвать желаемый ответ} . Если ЛС блокирует рецепторы, то механизм толерантности к нему может быть связан с up-регуляцией – увеличением числа рецепторов к лекарственному средству (b-адреноблокаторы)
3) включение компенсаторных механизмов регуляции (при повторных введениях гипотензивных препаратов коллапс возникает значительно реже, чем при первом введении за счет адаптации барорецепторов)
Б) относительная толерантность (псевдотолерантность) — развивается только при введении ЛС внутрь и связан со снижением скорости и полноты всасывания лекарства
3. Тахифилаксия – состояние, при котором частое введение ЛС вызывает развитие толерантности уже через несколько часов, но при достаточно редких введениях ЛС его эффект сохраняется в полной мере. Развитие толерантности связано обычно с истощением эффекторных систем.
4. Лекарственная зависимость – непреодолимое стремление к приему вещества, вводимого ранее. Выделяют психическую (кокаин) и физическую (морфин) лекарственную зависимости.
5. Гиперчувствительность – аллергическая или другая иммунологическая реакция на ЛС при повторном введении.
39. Зависимость действия лекарств от возраста, пола и индивидуальных особенностей организма. Значение суточных ритмов.
А) От возраста : у детей и у пожилых чувствительность к ЛС повышена (т. к. у детей существует недостаточность многих ферментов, функции почек, повышенная проницаемость ГЭБ, в пожилом возрасте замедлено всасывание ЛС, менее эффективно протекает метаболизм, понижена скорость экскреции препаратов почками):
|
1. У новорожденных снижена чувствительность к сердечным гликозидам, т. к. у них на единицу площади кардиомиоцита больше Na+/K+-АТФаз (мишеней действия гликозидов). 2. У детей ниже чувствительность к сукцинилхолину и атракурию, но повышена чувствительность ко всем другим миорелаксантам. 3. Психотропные средства могут вызвать у детей аномальные реакции: психостимуляторы – могут повышать концентрацию внимания и снижать моторную гиперактивность, транквилизаторы – напротив, способны вызвать т. н. атипичное возбуждение. |
1. Резко возрастает чувствительность к сердечным гликозидам в связи со снижением числа Na+/K+-АТФаз. 2. Снижается чувствительность к b-адреноблокаторам. 3. Повышается чувствительность к блокаторам кальциевых каналов, т. к. ослабляется барорефлекс. 4. Отмечается атипичная реакция на психотропные лекарственные средства, подобная реакции детей. |
Б) От пола:
1) гипотензивные средства – клонидин, b-адреноблокаторы, диуретики могут вызывать нарушение сексуальных функций у мужчин, но не влияют на работу репродуктивной системы женщин.
2) анаболические стероиды вызывают бóльший эффект в организме женщин, чем в организме мужчин.
В) От индивидуальных особенностей организма : дефицит или избыток тех или иных ферментов метаболизма ЛС приводит к увеличению или уменьшению их действия (дефицит псевдохолинэстеразы крови – аномально длительная миорелаксация при применении сукцинилхолина)
Г) От суточных ритмов : изменение действия ЛС на организм количественно и качественно в зависимости от времени суток (максимальное действие при максимальной активности).
40. Вариабельность и изменчивость действия лекарств. Гипо — и гиперреактивность, толерантность и тахифилаксия, гиперчувствительность и идиосинкразия. Причины вариабельности действия лекарств и рациональная стратегия терапии.
Вариабельность отражает разности между индивидуумами в ответ на данное лекарственное средство.
Причины вариабельности действия ЛС:
1) изменение концентрации вещества в зоне рецептора – из-за различий в скорости всасывания, его распределения, метаболизма, элиминации
2) вариации в концентрации эндогенного лиганда рецептора – пропранолол (β-адреноблокатор) замедляет ЧСС у людей с повышенным уровнем катехоламинов в крови, но не влияет на фоновую ЧСС у спортсменов.
3) изменение плотности или функции рецепторов.
4) изменение компонентов реакции, расположенных дистальнее рецептора.
Рациональная стратегия терапии : назначение и дозировка ЛС с учетом вышеперечисленных причин вариабельности действия ЛС.
Гипореактивность – снижение эффекта данной дозы ЛС по сравнению с тем эффектом, который наблюдается у большинства пациентов. Гиперреакцивность — повышение эффекта данной дозы ЛС по сравнению с тем эффектом, который наблюдается у большинства пациентов.
Толерантность, тахифилаксия, гиперчувствительность – см. в.38
Идиосинкразия – извращенная реакция организма на данное ЛС, связанная с генетическими особенностями метаболизма ЛС или с индивидуальной иммунологической реактивностью, в т. ч. с аллергическими реакциями.
41. Оценка безопасности лекарств. Терапевтический индекс и стандартные границы безопасности.
Оценка безопасности осуществляется на двух уровнях:
А) доклиническом (получения сведений о токсичности ЛС, влияния на репродуктивные функции, эмбриотоксичность и тератогенность, отдаленные эффекты)
Б) клиническом (дальнейшая оценка эффективности и безопасности ЛС)
Если после того, как достигается плато эффекта, доза ЛС будет продолжать расти, то через определенный промежуток времени начнет проявляться его токсическое действие. Зависимость токсического действия от дозы (концентрации) ЛС носит такой же характер, как и его полезный эффект и может быть описана градуальной или квантовой кривыми. На этих кривых также может быть определена величина TD 50 или ТС50 – токсическая доза (концентрация) ЛС, которая вызывает токсический эффект, равный 50% от максимального (для квантовой кривой – токсический эффект у 50% лиц в популяции). Иногда, вместо TD50 пользуются показателем LD 50 – летальная доза , которая вызывает гибель 50% объектов в популяции.
Оценка безопасности ЛС характеризуется на основе градульных или квантовых кривых «доза-эффект» и следующих показателей:
А) Терапевтический индекс – это соотношение между токсической и эффективной дозами лекарства, которые вызывают появление полумаксимального эффекта: ТИ=TD50/ED50. Чем больше величина терапевтического индекса, тем более безопасным является лекарство.
Б) Терапевтическая широта (терапевтическое окно) – это диапазон доз между минимальной терапевтической и минимальной токсической дозами ЛС. Является более корректным показателем безопасности ЛС, поскольку позволяет учитывать степень нарастания нежелательных эффектов на кривой «доза-эффект».
В) Фактор надежной безопасности – это отношение минимальной токсической дозы к максимальной эффективной (ФНБ=TD1/ED99), показывает, во сколько раз может быть превышена терапевтическая доза лекарства без риска развития интоксикации (нежелательных эффектов).
Г) Терапевтический коридор – это диапазон эффективных концентраций лекарственного вещества в крови, которые необходимо создать и поддерживать в организме, чтобы обеспечить достижение желаемого терапевтического действия.
42.46. Взаимодействие лекарств. Несовместимость ЛС (т. к. вопросы взаимосвязаны, выбирайте по обстоятельствам)
Взаимодействие ЛС – это изменение выраженности и характера эффектов при одновременном или предварительном применении нескольких лекарств.
Причины нежелательных взаимодействий:
1) полипрагмазия – 6 и более ЛС дают побочных эффектов в 7 раз больше, чем если ЛС меньше 6.
2) ошибки врачей
3) нарушение режима дозирования
Обоснование комбинированной терапии:
1. Монотерапия недостаточно эффективна.
2. Отсутствие при большинстве болезней этиотропной терапии Þ необходимость лекарственного воздействия на разные звенья патогенеза
3. Полиморбидность – чем старше человек, тем больше у него заболеваний, протекающих одновременно
4. Необходимость в коррекции нежелательных эффектов ЛС
5. Снижение количества приемов и введения ЛС {удобство для пациента, экономия труда медработников}
Виды взаимодействия:
I . Фармацевтическое взаимодействие — Вид взаимодействия, связанный с физико-химической реакцией между ЛС в процессе изготовления лекарственного препарата, еще до введения этих средств в организм человека
А) типичные ошибки, приводящие к фармацевтической несовместимости: выписывание сложных рецептов, неправильное хранение, не учитывается возможность адсорбции ЛС на поверхности пластмассы {органические нитраты}
Б) проблемы при инфузионной терапии: смешивание растворимых солей, производных нерастворимых слабых кислот или оснований приводит к их преципитации; в жидких лекарственных формах гидролизуются сердечные гликозиды и алкалоиды, разрушаются АБ; рН среды (в щелочной среде выпадают в осадок алкалоиды)
В) рекомендации: 1) Все смеси лучше готовить ex tempore 2) Наиболее надежен раствор с одним ЛС 3) Все растворы перед употреблением необходимо проверить на наличие взвесей 4) Взаимодействие может происходить без видимых изменений растворов 5) Нельзя добавлять ЛС в кровь и растворы АК 6) При отсутствии специальных указаний препараты следует растворять в 5%-ом р-ре глюкозы (рН 3,5-6,5), изотоническом растворе NaCl (рН 4,5-7,0).
Раствор глюкозы, стабилизированный HCl, несовместим с адреналином, бензилпенициллином, апоморфином, канамицином, витамином С, олеандомицином, сердечными гликозидами. Сердечные гликозиды несовместимы с атропином, папаверином, платифиллином. АБ несовместимы с гепарином, гидрокортизоном. Витамины группы В несовместимы между собой, с витаминами PP, С. Витамин РР и С также между собой несовместимы.
Нельзя смешивать ни с какими другими препаратами: фенотиазид, хлорпромазин, барбитураты, препараты витамина С, амфотерицин В, фуросемид, сульфадиазин, аминофиллин, адреномиметики.
II . Фармакологическое — взаимодействие лекарств, которое проявляется только в организме человека после их совместного применения
А) фармакокинетическое
1) на этапе всасывания.
При введении Per Os взаимодействие детерминируют:
1. кислотность среды
2. прямое взаимодействие в ЖКТ
Тетрациклины взаимодействуют с кальцием, аллюминием, железом, магнием с образованием хелатных комплексов. Холестирамин нарушает всасывание производных кислот, препаратов кальция, варварина, дигоксина, дигитоксина, жирорастворимых витаминов, триметоприма, клиндамицина, цефалексин, тетрациклина. Препараты железа лучше всасываются с витамином С. Препараты железа с карбонатами, тетрациклинами плохо всасываются.
3. моторика ЖКТ
Замедляют перистальтику: некоторые антидепрессанты, противогистаминные ЛС, фенотиазиновые антипсихотические, наркотические ЛС, повышают абсорбцию дигоксина, кортикостероидов, антикоагулянтов, снижают всасывание леводопы. Усиливают перистальтику и увеличивают эвакуацию из ЖКТ: метоклопрамид, слабительные. Снижают всасывание ЛС: фенобарбитал – гризеофульвина, аспирин – индометацина и диклофенака, ПАСК – рифампицина.
Способы контроля всасывания при парентеральном введении: местные анестетики + адреналин + фенилэфрин – снижается всасывание местных анестетиков
4. кишечная флора
5. изменение механизма всасывания
2) при распределении и депонировании:
1. прямое взаимодействие в плазме крови: гентамицин + ампициллин или карбенициллин – снижают активность гентамицина
2. конкурентное вытеснение из связи с альбуминами в плазме крови: индометацин, дигитоксин, варфарин связаны с белками крови на 90-98%, следовательно, повышение свободной фракции ЛС в два раза – резкое возрастание токсических эффектов; НПВС вытесняют: варфарин, фенитоин, метотрексат.
Детерминаты, определяющие клиническое значение такого взаимодействия:
ü величина Vd (большая – нет проблем, малая — возможны)
ü влияние одного ЛС вещества на активность механизмов транспорта через механизмы других ЛС: дозозависимо повышается транспорт ЛС – инсулин, АКТГ, ангиотензин, кинины и др.; инсулин повышает концентрацию изониазида только в легких, а концентрацию хлопромазина – только в ГМК.
3. вытеснение из связи с белками ткани: хинидин вытесняет дигоксин + снижает экскрецию почками, поэтому повышается риск токсичности дигоксина
3) в процессе метаболизма
ЛС могут повышать или снижать активность цитохрома Р450 и его ферментов {этанол повышает активность определенных изоферментов цитохрома}
Ингибиторы ферментов, часто вступающих во взаимодействие:
1. АБ: ципрофлоксацин, эритромицин, изониазид, метронидазол
2. Сердечно-сосудистые препараты: амиодарон, дилтиазем, хинидин, верапамил
3. Антидепрессанты: флуоксетин, сертрален
4. Антисекреторные препараты: циметидин, омепразол
5. Антиревматические препараты: аллопуринол
6. Фунгициды: флуконазол, интраканазол, кетоконазол, миконазол
7. Противовирусные: индинавир, ретонавир, саквинавир
8. Другие: дисульфирам, вальпроат натрия
Препараты, дающие токсические эффекты при ингибировании МАО: адреномиметики, симпатомиметики, антипаркинсонические, наркотические анальгетики, фенотиазины, седативные, антигипертензивные диуретики, гипогликемические ЛС
4) В процессе выведения — более 90% ЛС экскретируются с мочой.
Влияние на рН мочи и на степень ионизации ЛС, на их липофильность и их реабсорбцию
1. взаимодействие во время пассивной диффузии: часть ЛС экскретируется в неизменном виде, часть ЛС ионизируется при рН мочи 4,6-8,2. Ощелачивание мочи клинически важно: отравления ацетилсалициловой кислотой или фенобарбиталом, при приеме сульфаниламидов (снижение риска кристаллурии), приеме хинидина. Повышение кислотности мочи: повышается экскреция амфетамина (имеет практическое значение для выявления этого ЛС у спортсменов)
2. взаимодействие в период активного транспорта: пробенезид + пенициллин повышает продолжительность движения пенициллина, пробенецид + салицилаты – устранение урикозурического действия пробенецида, пенициллин + СА – снижение экскреции пенициллина
Влияние состава мочи на экскрецию ЛВ:
Увеличение сахара в моче – увеличение экскреции: витамина С, хлорамфеникола, морфина, изониазида, глутатиона и их метаболитов.
Б) фармакодинамическое –это взаимодействие ЛС, связанное с изменением фармакодинамики одного из них под влиянием другого {под влиянием тиреоидных гормонов усиливается синтез b-адренорецепторов в миокарде и усиливается влияние адреналина на миокард}.
Примеры клинически значимых нежелательных синергичных взаимодействий:
НПВС + варварин – увеличение риска кровотечения
Алкоголь + бензодиазепины – потенцирование седативного эффекта
Ингибиторы АПФ + К+-сберегающие диуретики – увеличение риска гиперкалиемии
Верапамил + b-Адреноблокаторы – брадикардия и асистолия
Алкоголь является сильным индуктором микросомальных ферментов, приводит к развитию толерантности к ЛС (особенно к наркозным и снотворным средствам), увеличивает риск развития лекарственной зависимости.
43. Взаимодействие лекарственных средств. Антагонизм, синергизм, их виды. Характер изменения эффекта лекарств (активности, эффективности) в зависимости от типа антагонизма.
При взаимодействии ЛС возможно развитие следующих состояний: а) усиление эффектов комбинации ЛС б) ослабление эффектов комбинации ЛС в) лекарственная несовместимость
Усиление эффектов комбинации ЛС реализуется в трех вариантах:
1) Суммирование эффектов или аддитивное взаимодействие – вид лекарственного взаимодействия при котором эффект комбинации равен простой сумме эффектов каждого из ЛС в отдельности. Т. е. 1+1=2 . Характерен для ЛС из одной фармакологической группы, которые имеют общую мишень действия {кислотонейтрализующая активность комбинации гидроокиси алюминия и магния равна сумме их кислотонейтрализующих способностей в отдельности}
2) синергизм – вид взаимодействия, при котором эффект комбинации превышает сумму эффектов каждого из веществ взятых по отдельности. Т. е. 1+1=3 . Синергизм может касаться как желаемых (терапевтических), так и нежелательных эффектов лекарств. Сочетанное введение тиазидного диуретика дихлотиазида и ингибитора АПФ эналаприла приводит к усилению гипотензивного действия каждого из средств, что применяется при лечении АГ. Однако одновременное назначение аминогликозидных антибиотиков (гентамицина) и петлевого диуретика фуросемида вызывает резкое возрастание риска ототоксического действия и развития глухоты.
3) потенцирование – вид лекарственного взаимодействия, при котором одно из ЛС, которое само по себе не оказывает данного эффекта, может приводить к резкому усилению действия другого лекарственного средства. Т. е. 1+0=3 {клавулановая кислота не обладает противомикробным действием, но способна усиливать эффект b-лактамного антибиотика амоксициллина за счет того, что она блокирует b-лактамазу; адреналин не оказывает местноанестезирующего действия, но при добавлении к раствору ультракаина он резко удлиняет его анестезирующий эффект за счет замедления всасывания анестетика из места инъекции}.
Ослабление эффектов ЛС при их совместном применении называют антагонизмом:
1) Химический антагонизм или антидотизм – химическое взаимодействие веществ между собой с образованием неактивных продуктов {химический антагонист ионов железа дефероксамин, который связывает их в неактивные комплексы; протамина сульфат, молекула которого имеет избыточный положительный заряд — химический антагонист гепарина, молекула которого имеет избыточный отрицательный заряд}. Химический антагонизм лежит в основе действия антидотов (противоядий).
2) Фармакологический (прямой) антагонизм – антагонизм, вызванный разнонаправленным действием 2 лекарственных веществ на одни и те же рецепторы в тканях. Фармакологический антагонизм может быть конкурентным (обратимым) и неконкурентным (необратимым):
А) конкурентный антагонизм: конкурентный антагонист обратимо связывается с активным центром рецептора, т. е. экранирует его от действия агониста. Т. к. степень связывания вещества с рецептором пропорциональна концентрации этого вещества, то действие конкурентного антагониста можно преодолеть если увеличить концентрацию агониста. Он будет вытеснять антагонист из активного центра рецептора и вызовет ответную реакцию ткани в полном объеме. Т. о. конкурентный антагонист не изменяет максимальный эффект агониста, но для взаимодействия агониста с рецептором требуется его более высокая концентрация. Конкурентный антагонист Сдвигает кривую «доза-эффект» для агониста вправо относительно исходных значений и увеличивает ЕС50 для агониста, не влияя на величину Е Max .
В медицинской практике достаточно часто используют конкурентный антагонизм. Поскольку эффект конкурентного антагониста может быть преодолен, если его концентрация упадет ниже уровня агониста, при лечении конкурентными антагонистами необходимо постоянно поддерживать его уровень достаточно высоким. Иными словами, клинический эффект конкурентного антагониста будет зависеть от периода его полуэлиминации и концентрации полного агониста.
Б) неконкурентный антагонизм: неконкурентный антагонист связывается практически необратимо с активным центром рецептора или же взаимодействует вообще с его аллостерическим центром. Поэтому, как бы ни повышалась концентрация агониста – он не в состоянии вытеснить антагонист из связи с рецептором. Поскольку, часть рецепторов, которая связана с неконкурентным антагонистом уже не способна активироваться, значение Е Max понижается, сродство же рецептора к агонисту не изменяется, поэтому значение ЕС50 остается прежним. На кривой зависимости «доза-эффект» действие неконкурентного антагониста проявляется в виде сжатия кривой относительно вертикальной оси без ее смещения вправо.
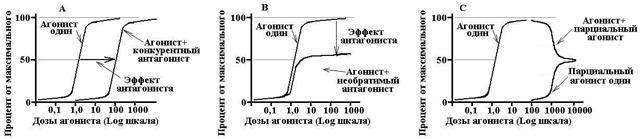
Схема 9. Виды антагонизма.
А – конкурентный антагонист смещает кривую «доза-эффект» вправо, т. е. снижает чувствительность ткани к агонисту, не изменяя его эффект. В – неконкурентный антагонист снижает величину ответа ткани (эффект), но не влияет на ее чувствительность к агонисту. С – вариант применения парциального агониста на фоне полного агониста. По мере повышения концентрации парциальный агонист вытесняет полный из рецепторов и в итоге ответ ткани снижается от максимального ответа на полный агонист, до максимального ответа на агонист парциальный.
Неконкурентные антагонисты применяются в медицинской практике реже. С одной стороны они имеют несомненное преимущество, т. к. действие их не может быть преодолено после связывания с рецептором, а значит не зависит ни от периода полуэлиминации антагониста, ни от уровня агониста в организме. Эффект неконкурентного антагониста будет определяться лишь скоростью синтеза новых рецепторов. Но с другой стороны, если происходит передозировка данного лекарства, устранить его эффект будет чрезвычайно сложно.
|
Конкурентный антагонист |
Неконкурентный антагонист |
|
Похож по строению на агонист |
По строению отличается от агониста |
|
Связывается с активным центром рецептора |
Связывается с аллостерическим участком рецептора |
|
Смещает кривую «доза-эффект» вправо |
Смещает кривую «доза-эффект» по вертикали |
|
Антагонист снижает чувствительность ткани к агонисту (ЕС50), но не влияет на максимальный эффект (Еmax), который может быть достигнут при более высокой концентрации. |
Антагонист не изменяет чувствительность ткани к агонисту (ЕС50), но уменьшает внутреннюю активность агониста и максимальную реакцию ткани на него (Еmax). |
|
Действие антагониста может быть устранено высокой дозой агониста |
Действие антагониста не может быть устранено высокой дозой агониста. |
|
Эффект антагониста зависит от соотношения доз агониста и антагониста |
Эффект антагониста зависит только от его дозы. |
Конкурентным антагонистом в отношении АТ1-рецепторов ангиотензина является лозартан, он нарушает взаимодействие ангиотензина II с рецепторами и способствует снижению артериального давления. Действие лозартана можно преодолеть, если ввести высокую дозу ангиотензина II. Неконкурентным антагонистом в отношении этих же АТ1-рецепторов является валсартан. Его действие нельзя преодолеть даже при введении высоких доз ангиотензина II.
Интересным является взаимодействие, которое имеет место между полным и парциальным агонистами рецепторов. Если концентрация полного агониста превышает уровень парциального, то в ткани наблюдается максимальный ответ. Если уровень парциального агониста начинает повышаться, он вытесняет полный агонист из связи с рецептором и ответ ткани начинает уменьшаться от максимального для полного агониста, до максимального для парциального агониста (т. е. такого уровня, при котором он займет все рецепторы).
3) Физиологический (непрямой) антагонизм – антагонизм, связанный с влиянием 2 лекарственных веществ на различные рецепторы (мишени) в тканях, что приводит к взаимному ослаблению их эффекта. Например, физиологический антагонизм наблюдается между инсулином и адреналином. Инсулин активирует инсулиновые рецепторы в результате чего увеличивается транспорт глюкозы в клетку и уровень гликемии понижается. Адреналин активирует b2-адренорецепторы печени, скелетных мышц и стимулирует распад гликогена, что в итоге приводит к повышению уровня глюкозы. Данный вид антагонизма часто используется при оказании неотложной помощи пациентам с передозировкой инсулина, которая привела к гипогликемической коме.
44. Побочные и токсические эффекты лекарственных веществ. Тератогенное, эмбриотоксическое, мутагенное действие лекарств.
Побочные эффекты – те эффекты, которые возникают при применении веществ в терапевтических дозах и составляют спектр их фармакологического действия {анальгетик морфин в терапевтических дозах вызывает эйфорию}, могут быть первичными и вторичными:
А) первичные побочные эффекты – как прямое следствие влияния данного препарата на определенный субстрат {гипосаливация при применении атропина для устранения брадиаритмии}
Б) вторичные побочные эффекты – косвенно возникающие неблагоприятные влияния {АБ, подавляя нормальную микрофлору, могут привести к суперинфекции}
Токсические эффекты – нежелательные эффекты, проявляющиеся у данного ЛС при выходе из терапевтического диапазона {передозировка ЛС}
Избирательность действия ЛС зависит от его дозы. Чем выше доза препарата, тем менее избирательным он становится.
Тератогенное действие – способность ЛС при назначении его беременной женщине вызывать анатомические аномалии развития плода {талидомид: фокомелия, противобластомные ЛС: множественные дефекты}
Эмбриотоксическое действие – неблагоприятное воздействие, не связанное с нарушением органогенеза в первые три месяца беременности. На более поздних сроках проявляется Фетотоксическое действие .
Мутагенное действие ЛС – повреждение зародышевой клетки и ее генетического аппарата ЛС, что проявляется изменением генотипа потомства {адреналин, цитостатики}.
Канцерогенное действие ЛС – способность некоторых ЛС индуцировать канцерогенез.
45. Медицинские и социальные аспекты борьбы с лекарственной зависимостью, наркоманиями и алкоголизмом. Понятие о токсикоманиях.
«То, что человечество в целом будет когда-либо обходиться без искусственного рая, маловероятно. Большинство мужчин и женщин ведут такую тягостную жизнь, которая в лучшем случае так монотонна, убога и ограничена, что желание «уйти» от нее, отключиться хотя бы на несколько мгновений, есть и всегда было одним из основных ЖелаНий души » (Huxley, работа «The Doors of Perception»)
1) Лекарственная зависимость – состояние психики и/или физическое состояние, которое является следствием воздействия на организм ЛС и характеризуется специфическими поведенческими реакциями, трудно преодолимым стремлением повторно принимать ЛС, чтобы добиться особого психического эффекта или избежать дискомфорта при отсутствии ЛС в организме. Лекарственная зависимость характеризуется:
А) Психологической зависимостью – развитием эмоционального дистресса при прекращении приема ЛС. Человек ощущает себя опустошенным, погружается в депрессию, испытывает чувство страха, тревоги, его поведение становится агрессивным. Все эти психопатологические симптомы возникают на фоне мыслей о необходимости ввести себе ЛС, вызвавшее зависимость. Стремление к приему ЛС может колебаться от простого желания до страстной жажды приема ЛС, которая поглощает все остальные потребности и превращается в смысл жизни человека. Считают, что психологическая зависимость развивается тогда, когда у человека появляется сознание того, что оптимального самочувствия он может достигнуть исключительно благодаря введению ЛС. Основа психологической зависимости — вера человека в действие лекарства (в литературе описаны случаи развития психологической зависимости к плацебо).
Б) Физической зависимостью — нарушением нормального физиологического состояния организма, которое требует постоянного присутствия в нем ЛС для поддержания состояния физиологического равновесия. Прекращение приема лекарства вызывает развитие специфического симптомокомплекса — абстинентного синдрома – комплекса психических и нейровегетативных расстройств в виде нарушения функции в сторону, противоположную той, которая характерна для действия {морфин устраняет боль, угнетает дыхательный центр, суживает зрачки, вызывает запор; при абстиненции у пациента возникают мучительные боли, частое шумное дыхание, зрачки расширены и развивается упорная диарея}
В) Толерантностью . Толерантность к средствам, вызывающим лекарственную зависимость зачастую носит перекрестный характер, т. е. возникает не только к данному химическому соединению, но и ко всем структурно подобным соединениям. Например, у пациентов с лекарственной зависимостью к морфину толерантность возникает не только к нему, но и к другим опиоидным анальгетикам.
Для развития лекарственной зависимости наличие всех 3 критериев не является необходимым условием, в таблице 3 представлены основные виды лекарственной зависимости и составляющие ее компоненты.
Опиоиды, барбитураты, алкоголь вызывают сильные физическую, психологическую зависимости и толерантность. Анксиолитики (диазепам, альпразолам) преимущественно вызывают психологическую зависимость.
2) Наркомания (наркотическая зависимость) – это крайне тяжелая форма лекарственной зависимости, компульсивное применение ЛС, характеризующееся все возрастающим, непреодолимым влечением к введению данного лекарства все увеличивая его дозы. Компульсивность влечения означает, что потребность во введении лекарства доминирует у пациента над всеми другими (даже витальными) потребностями. С позиций данного определения, влечение к морфину – наркомания, тогда как влечение к никотину – лекарственная зависимость.
3) Пристрастие к лекарству — характеризует менее интенсивное влечение к приему лекарств, когда отказ от лекарства вызывает только ощущение легкого дискомфорта, без развития физической зависимости или развернутой картины психологической зависимости. Т. о. пристрастие охватывает ту часть лекарственной зависимости, которая не подпадает под определение наркомании. Например, упомянутая выше лекарственная зависимость к никотину – форма пристрастия.
4) Злоупотребление лекарственными средствами – самовольное применение лекарственных средств в таких дозах и такими способами, которые отличаются от принятых медицинских или социальных стандартов в данной культуре и в данное время. Т. о. злоупотребление ЛС охватывает только социальные аспекты применения лекарств. Примером злоупотребления является использование анаболических стероидов в спорте или для улучшения телосложения молодыми мужчинами.
5) Алкоголизм – хроническое злоупотребление алкоголя (этилового спирта), приводящее со временен к поражению ряда органов (печени, ЖКТ, ЦНС, сердечно-сосудистой системы, иммунной системы) и сопровождающееся психико-физической зависимостью.
6) Токсикомания – хроническое злоупотребление различными ЛС (в т. ч. наркотиками, алкоголем, галлюциногенами), проявляющееся многообразными психическими и соматическими расстройствами, нарушением поведения, социальной деградацией.
Лечение лекарственной зависимости трудная и неблагодарная задача. До сих пор не создано эффективной методики, которая бы обеспечивала бы успех лечения более чем у 30-40% пациентов. Достижение сколько-нибудь заметных результатов возможно только при полной кооперации усилий пациента, врача и того социального окружения, в котором находится заболевший (принцип добровольности и индивидуальности). В основе современных методик лежат следующие принципы:
ü психотерапевтические и трудотерапевтические методы;
ü групповое лечение и реабилитация (общества анонимных алкоголиков, наркоманов)
ü постепенная или резкая отмена препарата на фоне детоксикационной терапии
ü проведение заместительной терапии (замена наркотического средства медленно и длительнодействующими аналогами с их последующей отменой; например, т. н. программа метадоновой заместительной терапии у героиновых наркоманов)
ü лечение специфическими антагонистами (налоксоном и налтрексоном) или сенсибилизирующими средствами (тетурамом)
ü нейрохирургический методы криодеструкции поясной извилины и гиппокампа
47. Виды фармакотерапии. Деонтологические проблемы фармакотерапии.
Фармакотерапия (ФТ ) — совокупность методов лечения, основанных на применении ЛС. Основные виды ФТ:
1. этиотропная ФТ – коррекция и устранение причины заболевания {АБ при инфекционных заболеваниях}
2. патогенетическая ФТ – воздействие на механизм развития болезни {ингибиторы АПФ при АГ}
3. симптоматическая ФТ – устранение симптомов заболевания при невозможности влияния на его причину или патогенез {НПВС при гриппе}
4. заместительная ФТ – применение ЛС при недостаточности естественных БАВ {инсулин при СД}
5. профилактическая ФТ {вакцины, сыворотки, ацетилсалициловая кислота при ИБС}
Отношение общества к ЛС на современном этапе : 1) желание получить выгоды без риска 2) надежда на чудо, сверхожидания 3) непонимание риска использования ЛС 4) возмущение и «праведное негодование», поспешные оценки ЛС 5) желание получения новых ЛС
Отношение врача к ЛС : терапевтический оптимизм (надежда на ЛС, как мощный компонент терапии), терапевтический нигилизм (отрицание новых ЛС, приверженность к определенным ЛС, недоверие новым ЛС)
Комплаентность (приверженность) больного к лечению : 1) понимание инструкций врача и целей лечения 2) стремление точно следовать предписаниям врача.
В настоящее время в мире порядка 100.000 ЛС, более 4.000 зарегистрировано в РБ, из них жизненно важных около 300 препаратов. Изучение фармакологии помогает не утонуть в море препаратов.
48. Основные принципы лечения и профилактика отравлений лекарственными веществами. Антидотная терапия.
Классификация отравляющих веществ (ОВ):
1. По принадлежности к определенным классам химических соединений: барбитураты, бензодиазепины, цианиды.
2. По происхождению: небиологической природы (кислоты, щелочи, соли тяжелых металлов), токсические продукты жизнедеятельности некоторых МБ (ботулотоксин), растительного происхождения (алколоиды, гликозиды), животного происхождения (яды змей, пчел)
3. По степени токсичности: а) чрезвычайно токсические (DL50 < 1 мг/кг) б) высоко токсические (1-50) в) сильно токсические (50-500) г) умеренно токсические (500-5000) д) мало токсические (5000-15000) е) практически нетоксические (> 15.000)
4. По токсикологическому действию: а) нервно-паралитического (бронхоспазм, удушье) б) кожно-резорбтивные в) общетоксические (гипоксические судороги, кома, параличи) г) удушающие д) слезоточивые и раздражающие е) психотропные (нарушение психической активности, сознания)
5. В зависимости от сферы преимущественного использования: промышленные яды, ядохимикаты, бытовые яды, боевые отравляющие вещества, лекарственные вещества.
6. В зависимости от токсичности ЛС: список А – ЛС, назначение, применение, дозирование и хранение которых в связи с высокой токсичностью должны производиться с высокой осторожностью. К этому же списку относятся ЛС, вызывающие наркоманию; список В — ЛС, назначение, применение, дозирование и хранение которых должны производиться с предосторожностью в связи с возможными осложнениями при их применении без медицинского контроля.
Избирательно токсическое действие ЛС.
А) кардиотоксическое: сердечные гликозиды, препараты калия, антидепрессанты
Б) нейротоксическое: психофармакологические средства, оксихинолины, аминогликозиды
В) гепатотоксические: тетрациклины, левомицетин, эритромицин, парацетамол
Г) нефротоксическое: ванкомицин, аминогликозиды, сульфаниламиды
Д) гастроентеротоксическое: стероидные противовоспалительные средства, НПВС, резерпин
Е) гематотоксическое: цитостатики, левомицетин, сульфаниламиды, нитраты, нитриты
Ж) пневмотоксические
Токсикокинетика – изучает всасывание, распределение, метаболизм и выведение ЛС, принятых в токсических дозах.
Поступление отравляющих веществ в организм возможно а) энтерально б) парентерально. Скорость и полнота всасывания отражает скорость развития токсического эффекта и его выраженность.
Распределение в организме: Vd=D/Cmax – действительный объем, в котором распределяется в организме отравляющее вещество. Vd > 5-10 л/кг – ОВ трудно допустимо для его удаления (антидепрессанты, фенотиазины). Vd < 1 л/кг – ОВ легче удалить из организма (теофиллин, салицилаты, фенобарбитал).
Передозировка – изменение фармакокинетических процессов: растворимости, связи с белками, метаболизма ® значительное повышение свободной фракции ЛС ® токсические эффект.
Кинетика первого порядка при увеличении концентрации ЛС переходит в кинетику нулевого порядка.
Токсигенная стадия – дезинтоксикационная терапия, соматогенная стадия – симптоматическая терапия.
Токсикодинамика . Основные механизмы токсического действия:
А) медиаторный: прямой (по типу конкурентной блокады – ФОС, психомиметики) и непрямой (активаторы или ингибиторы ферментов)
Б) взаимодействие с биомолекулами и внутриклеточными структурами (гемолитические вещества)
В) метаболизм по типу летального синтеза (этиловый спирт, тиофос)
Г) ферментный (яды змей и др.)
Виды действия: местное, рефлекторное, резорбтивное.
Классификация отравлений:
1. Этиопатогенетическая:
а) случайное (самолечение, ошибочный прием)
б) преднамеренное (с целью самоубийства, убийства, развития у пострадавшего беспомощного состояния)
2. Клиническая:
а) в зависимости от скорости развития отравления: острое (поступление однократно или с коротким интервалом времени токсической дозы вещества), подострое (замедленное развитие клинической картины после однократного приема), хроническое
б) в зависимости от проявления основного синдрома: поражение ССС, поражение ДС и др.
в) в зависимости от тяжести состояния больного: легкой, средней, тяжелой, крайне тяжелой
3. Нозологическая: учитывает название ЛС, название группы веществ
Общий механизм смерти при отравлении:
А) поражение ССС:
1) снижение АД, гиповолемия периферических сосудов, коллапс, бради — или тахикардия (трициклические антидепрессанты, бета-блокаторы, блокаторы кальциевых каналов)
2) аритмии (желудочковая тахикардия, фибрилляция – трициклические антидепрессанты, теофиллин, амфетамин)
Б) поражение ЦНС: ступор, кома ® угнетение дыхания (наркотики, барбитураты, алкоголь, гипно-седативные ЛС)
В) судороги, мышечная гиперреактивность и ригидность ® гипертермия, миоглобинурия, почечная недостаточность, гиперкалиемия
Токсикологическая триада:
1) длительность применения, доза и вещество ® анамнез.
2) оценка состояния сознания по симптомам: дыхания, АД, температура тела
3) лабораторные данные
Основные принципы лечения:
I. Первая неотложная помощь : искусственное дыхание, массаж сердца, противошоковая терапия, контроль за водно-электролитным балансом
II . Задержка всасывания и удаление из организма не всосавшегося ОВ:
Цель: прекратить контакт с ОВ
1. Парентеральный путь:
а) через легкие:
1) прекратить ингаляцию
2) раздражающие вещества (нашатырный спирт, формальдегид) ® закрепить активные движения, согреть, дать кислород и пеногасители (у нашатырного спирта пеногаситель уксус, а у формальдегида – разбавленный раствор нашатырного спирта)
б) через кожу: смыть обильным количеством теплой воды с мылом или моющим средством, специфические противоядия, нейтрализация и прекращение воздействия ОВ на кожу (ФОС: обмывают водой, удаляют с помощью 10-15% нашатырного спирта или 5-6% раствора гидрокарбоната натрия с водой; фенолкрезол: растительное масло или этиленгликоль, но нельзя вазелиновое масло, KMNO4: 0,5-1%-ый раствор аскорбиновой кислоты или равные объемы 3% перекиси водорода и 3% раствора уксусной кислоты, CCl4, скипидар, бензин: теплая мыльная вода)
в) при инъекции в конечность: жгут выше места инъекции
г) при попадании в глаза: промывание теплым физраствором или молоком в течении 10-20 минут, закапать местный анестетик; при попадании кислот и щелочей нельзя нейтрализовать. Обязательна консультация офтальмолога.
2. Энтеральный путь: освободить желудок от ОВ, ускорить пассаж
а) удаление ОВ:
1) предварительно прием воды. Нельзя принимать молоко (исключение – едкие отравляющие вещества) и этанол (исключение –метанол).
2) рвота – показана преимущественно при отравлении крупными таблетками или капсулами, которые не могут пройти через зонд. Можно спровоцировать рефлекторно или рвотными средствами (NaCl: 1 столовая ложка на 1 стакан воды; сироп ипекакуаны: взрослым 2 столовые ложки, детям 2 чайные ложки; горчица: 1-2 чайные ложки на стакан воды; апоморфин: 5-10 мг/кг подкожно, кроме детей до 5 лет). Нельзя вызывать рвоту после приема: органических растворителей – опасность ингаляций, моющих средств – пенообразование, судорожных ОВ – опасность аспирации, едких веществ – повреждение пищевода)
3) зондовое промывание желудка – является экстренным и обязательным мероприятием. Желудок промывают, если с момента отравления прошло не более 4-6 часов, иногда до 10 часов; при отравлении ацетилсалициловой кислотой – через 24 часа. Предварительно интубируют пациента трубкой с раздувной манжетой: в коматозном состоянии при отсутствии кашлевого и ларингеального рефлекса. Желудок промывают водой или физраствором 30° С, время процедуры 4 часа и более. В конце промывания – активированный уголь и сульфат натрия.
б) снижения всасывания из ЖКТ: активированный уголь внутрь после опорожнения желудка + сульфат натрия или магния. Особенности мероприятий по снижению всасываемости:
1) органические растворители: нельзя вызывать рвоту, промывание желудка после интубации, активированный уголь + вазелиновое масло
2) моющие средства: нельзя вызывать рвоту и промывать желудок, необходимо давать много воды + пеногасители (симетикон)
3) кислоты и щелочи: нельзя вызывать рвоту, промывание желудка через зонд, смазанный растительным маслом после введения наркотического анальгетика – единственное показание для дачи молока. При отравлении кислотами – антациды, при отравлении щелочи – лимонная или уксусная кислоты.
III . Удаление из организма всосавшегося ОВ
а) форсированный диурез (условия: достаточный почечный кровоток и клубочковая фильтрация; за 24 часа влить-вылить 20-25 литров)
б) перитонеальный гемодиализ
в) гемосорбция
г) обменное переливание крови
д) форсированная гипервентиляция
IV . Симптоматическая терапия функциональных нарушений.
Антидоты: 1) токсикотропные – связывающие, нейтрализующие и предупреждающие всасывание ОВ: действующие по принципу активированного угля, действующие по химическому принципу (унитиол, пеницилламин, пентацин)
2) токсикокинетические – ускоряют биотрансформацию ОВ (тримедоксима бромид, натрия тиосульфат, этанол, АО)
3) фармакологические – атропин, налоксон
4) иммунологические противоядия
Унитиол, сукцимер – связывает тяжелые металлы, металлоиды, сердечные гликозиды. Эсмолол связывает теофиллин, кофеин. Кальция тринатрия пентотат – образует комплексы с двух и трехвалентными металлами.
49. Рецепт и его структура. Общие правила выписывания рецепта. Государственная регламентация правил выписывания и отпуска лекарств.
Рецепт — это письменное обращение врача к фармацевту с требованием отпустить лекарство в определенной форме и дозировке с указанием способа его применения
В рецепте различают следующие части:
1. Inscriptio — заглавие, надпись. Здесь пишется дата выдачи рецепта, фамилия, инициалы и возраст больного, фамилия и инициалы врача.
2. Invocatio — обращение к фармацевту. Выражается словом “Recipe” (возьми) или сокращенным обозначением (Rp.)
3. Designatio materiarum — обозначение или наименование лекарственных препаратов с указанием их доз. В сложном рецепте перечисление лекарственных веществ делается в определенной последовательности. Первым указывается основное лекарственное вещество (basis). Затем пишут вспомогательные вещества (adjuvans). После этого указывают инградиенты, исправляющие вкус, запах, цвет лекарства (corrigens). Последними пишутся вещества, которые придают лекарству определенную лекарственную форму (constituens).
4. Subscriptio — предписание (указание) фармацевту. Здесь указывается лекарственная форма, фармацевтические операции, необходимые для ее изготовления, количество отпускаемых доз лекарства.
5. Signatura — указание больному о том, как пользоваться лекарством.
6. Subscriptio medici — подпись врача, выписавшего рецепт, его личная печать.
Обращение врача к фармацевту, название лекарств, входящих в состав рецепта, название лекарственной формы и характер фармацевтических операций пишутся на латинском языке. Название лекарств, ботанические названия растений пишутся с заглавной буквы. Предписание больному пишется на русском или национальном языках.
Общие правила выписывания рецепта:
1. Рецепт пишется на специальной форме в зависимости от выписываемого ЛС четким почерком, чернилами или шариковой ручкой без исправлений.
2. В рецепте указывается число, месяц, год, фамилия, имя, отчество и возраст больного, фамилия, имя и отчество врача. Затем идет текст рецепта, где перечисляются входящие в рецепт названия веществ в родительном падеже с указанием их количества
3. Единица массы в рецептах – грамм или ЕД.
4. Если превышают максимальную дозу ядовитых и сильнодействующих веществ, ее подтверждают прописью
5. Рецепт подтверждается подписью и личной печатью врача
В РБ действует Государственная регламентация правил выписывания и отпуска лекарств.
50. Правила выписывания ядовитых, наркотических и сильнодействующих средств.
К списку А отнесены ЛС, назначение, применение, дозирование и хранение которых в связи с высокой токсичностью должны производиться с высокой осторожностью. К этому же списку относятся ЛС, вызывающие наркоманию.
К списку В отнесены ЛС, назначение, применение, дозирование и хранение которых должны производиться с предосторожностью в связи с возможными осложнениями при их применении без медицинского контроля.
Для ядовитых и сильнодействующих ЛС установлены максимальные высшие разовые и суточные дозы. Эти дозы рассчитаны на взрослых людей, достигших 25 лет. При пересчете доз для людей старше 60 лет учитывается возрастная чувствительность к разным группам ЛС. Дозы препаратов, угнетающих ЦНС, а также сердечных гликозидов и диуретиков уменьшаются на 50%, дозы других ядовитых и сильнодействующих ЛС снижаются до 2/3 от дозы взрослого. Дозы АБ, сульфаниламидов и витаминов обычно одинаковы для всех возрастных групп, начиная с 25 лет.
1. Наркотические ЛС (список А) выписываются на рецептурном бланке формы 2. Один бланк – одно лекарство. Должны быть: подпись и печать лечащего врача, подпись главного врача ЛПУ, круглая печать ЛПУ.
2. Ядовитые ЛС (список А), сильнодействующие (список Б) выписываются на рецептурном бланке формы 1. Должны быть подпись и личная печать врача, печать ЛПУ.
51. Лекарственные средства, находящиеся под контролем. Лекарства, запрещённые для выписывания в рецептах.
Под контролем находятся наркотические, ядовитые и сильнодействующие ЛС (см. в. 20)
А) ЛС, не зарегистрированные в РБ и не разрешенные к официальному применению
Б) ЛС по просьбе больных и их родственников без осмотра больного и установления диагноза
В) рецепты на наркотические ЛС для инъекций, эфир наркозный, хлорэтил, пентамин, фторотан, натрия оксибутират в ампулах, лития оксибутират, бария сульфат для рентгеноскопии.
52. Фармакокинетические модели (однокамерная и двухкамерная), количественные законы всасывания и элиминации лекарств.
![]() Однокамерная модель.
Однокамерная модель.
Весь организм – единый однородный контейнер. Допущения:
1) устанавливается быстрое динамическое развитие между содержанием препарата в кровяном русле и его концентрацией в экстраваскулярных тканях
2) ЛС быстро и равномерно распределяется по всему объему крови
3) Элиминация ЛС подчиняется кинетике первого порядка: скорость уменьшения содержания препарата в крови пропорциональна его концентрации
Если механизмы для устранения лекарственного средства (биотрансформация в печени, почечная секреция) не насыщены при введении терапевтической дозы, логнормальный график изменения плазменной концентрации во времени будет линеен.
Наклон логнормальной оси — Kel, где Kel — постоянная скорости элиминации и имеет размерность время-1. Значение С0 получается экстраполяцией графика до пересечения с осью ординат. Плазменная концентрация ЛВ (Ct) в любое время t после введения в организм составляет:
Ln Ct = Ln C0 – kt. Константа элиминации Kel, Vd, и общий клиренс (CL) связаны выражением: CL = k × Vd
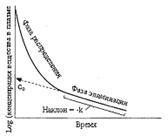 Двухкамерная модель.
Двухкамерная модель.
Часто после поступления ЛС в организм не удается быстро достичь равновесия между содержанием ЛС в крови и его концентрацией в экстраваскулярной жидкости. Тогда полагают, что в совокупности тканей и биологических жидкостей организма можно выделить две камеры, которые отличаются степенью доступности для проникновения ЛС. К центральной камере относится кровь (часто с интенсивно перфузируемыми органами – печень, почки), к периферической – интерстициальная жидкость внутренних органов и тканей.
Результирующий график показывает начальную Фазу распределения (Время, требуемое ЛС для достижения равновесного состояния между центральной и периферической камерами и следующую за ней медленную Фазу элиминации Первого порядка.
Значение С0, получается экстраполяцией Фазы элиминации до пересечения с осью ординат. С0 используется для вычисления объема распределения и константы элиминации. Формулы для расчета Сt и Cl, приведенные для однокамерной модели, также применяются в течение фазы элиминации для препаратов, которые удовлетворяют условиям модели с двумя камерами.
53. Селективность и специфичность действия лекарств. Терапевтические, побочные и токсические эффекты лекарств, их природа с позиций концепции рецепторов. Терапевтическая стратегия борьбы с побочными и токсическими эффектами лекарств.
Специфичность – это когда ЛС связывается со строго специфичным ему типом рецептора.
Селективность — это когда ЛС способно связываться с одним или несколькими типами рецепторов более точно, чем с другими.
Более предпочтительно использовать термин селективность, т. к. маловероятно, что любая молекула ЛС может связаться только с одним типом рецепторных молекул, поскольку число потенциальных рецепторов у каждого пациента имеет астрономическое значение.
Терапевтическое действие - основной желательный фармакологический эффект, ожидаемый от данного фармакологического препарата.
Побочные эффекты – те эффекты, которые возникают при применении веществ в терапевтических дозах и составляют спектр их фармакологического действия.
Токсические эффекты – нежелательные эффекты, проявляющиеся у данного ЛС при выходе из терапевтического диапазона.
Связи терапевтического и токсического эффектов ЛС на основе анализа рецепторно-эффекторных механизмов:
1) терапевтический и токсический эффекты, опосредуемые одним и тем же рецепторно-эффекторным механизмом {празозин действует как альфа-селективный антагонист на рецепторы ГМК сосудов и оказывает гипотензивное действие при эссенциальной гипертензии, но при его большой дозе у больного может возникнуть постуральная гипотензия}
2) терапевтический и токсический эффекты, опосредуемые идентичными рецепторами, но различными тканями или различными эффекторными путями {сердечные гликозиды используют для увеличения сократительной способности миокарда, в тоже время они нарушают функцию ЖКТ, зрения за счет блокады Na+/K+-АТФазы клеточной мембраны}
3) терапевтический и токсический эффекты, опосредуемый различными типами рецепторов {например, норадреналин оказывает гипертензивное действие через a1-Ар, но при этом вызывает тахикардию через b1-Ар}
Терапевтическая стратегия борьбы с терапевтическими и побочными эффектами ЛС:
1. ЛС всегда следует вводить в наименьшей дозе, которая вызывает приемлемый терапевтический эффект
2. Снижение дозы одного ЛС за счет назначения другого ЛС со сходным действием, но через иные рецепторы и с иным профилем токсичности.
3. Селективность действия ЛС может быть увеличена путем управления концентрацией ЛС в районе рецепторов различных отделов организма (местное применение ЛС – ингаляционное применение сальбутамола при бронхиальной астме)
