System zapewnienia jakości w organizacjach farmaceutycznych. Stworzenie systemu zarządzania jakością leków w aptece
Wyszukiwanie pełnotekstowe:
Strona główna > Abstrakt >Medycyna, zdrowie
leki w aptece
Zarządzenie Ministra Zdrowia Federacji Rosyjskiej nr 80 z dnia 4 marca 2003 r. „W sprawie zatwierdzenia standardu branżowego „Zasady wydawania (sprzedaży) leków w organizacje farmaceutyczne. Przepisy podstawowe”. Zawiera rozdział IX „Zapewnienie jakości”. leki(leki) w organizacjach farmaceutycznych.
Organizacje farmaceutyczne lub indywidualni przedsiębiorcy muszą stworzyć system zapewnienia jakości, obejmujący:
pomieszczenia i wyposażenie odpowiadające wielkości działalności placówki aptecznej i umożliwiające zapewnienie przestrzegania warunków przechowywania i wytwarzania leków;
dokumentację pozwalającą na identyfikację pochodzenia, ilości i jakości przyjmowanych leków oraz prowadzenie ewidencji przechowywanych i sprzedawanych leków;
kontrola przychodząca leków wprowadzanych do organizacji farmaceutycznej lub indywidualnego przedsiębiorcy;
personel posiadający niezbędne kwalifikacje;
system ciągłego szkolenia personelu;
zbiór materiałów regulacyjnych i referencyjnych, które powinny być dostarczone do wszystkich placówek aptecznych danej organizacji aptecznej.
Organizacja apteki musi posiadać system zarządzania jakością organizacji apteki.
Każda organizacja apteki musi posiadać wewnętrzny regulamin pracy zatwierdzony przez kierownika organizacji, z informacją, że pracownicy go przeczytali. Regulamin podlega corocznej weryfikacji i ponownemu zapoznawaniu się z nim przez personel apteki.
Organizacje apteczne muszą regularnie przeprowadzać audyty wewnętrzne pod kątem zgodności z wymogami GOST. Podczas przeprowadzania kontroli należy zwrócić uwagę na dostępność w organizacji apteki odpowiednich dokumentów dotyczących zajmowanego lokalu, opisów stanowisk pracy pracowników, standardów i innych niezbędnych dokumentów.
Kontrole mogą przeprowadzać zarówno pracownicy organizacji aptekarskiej, niezależni od osób bezpośrednio wykonujących kontrolowaną działalność, jak i niezależni eksperci. Częstotliwość kontroli ustala sama apteka. Wyniki kontroli są rejestrowane i podawane do wiadomości personelu odpowiedzialnego za kontrolowany obszar pracy oraz kierownictwa organizacji apteki. Kolejne audyty monitorują realizację zaleceń i ich skuteczność. Każdy pracownik organizacji aptecznej musi znać GOST, procedurę wykonywania powierzonych mu obowiązków, przepisy i standardy związane z działalnością organizacji. W organizacjach farmaceutycznych każdy pracownik musi mieć zatwierdzony w odpowiedni sposób opis stanowiska pracy.
Organizacje apteczne muszą posiadać system ciągłego doskonalenia zawodowego pracowników w zakresie obowiązującego ustawodawstwa, stosowania leków itp. Plan i tematyka zajęć zatwierdza kierownik organizacji apteki. Szef organizacji apteki wyznacza przedstawiciela ds. Jakości spośród kadry kierowniczej.
W tym zakresie nie ma wątpliwości co do konieczności ciągłego podnoszenia kwalifikacji zawodowych personelu farmaceutycznego. Jednym ze sposobów rozwiązania tego problemu jest zwiększenie efektywności systemu kształcenia podyplomowego farmaceutów.
Organizacja apteki zapewnia prowadzenie dokumentacji zgodnie z przepisami prawa i regulacjami Federacja Rosyjska.
Przede wszystkim zadaniem apteki jest zapewnienie zachowanych cech towarów otrzymywanych przez organizację apteki. Są to dwie grupy: walory użytkowe – efektywność i bezpieczeństwo, fizyczne i fizykochemiczne, wymagające przestrzegania zasad postępowania z nimi. W ramach systemu zarządzania jakością organizacji apteki każda apteka musi zorganizować:
1. Kontrola akceptacji. Ma to na celu zapobieganie przyjmowaniu i sprzedaży przez sieć aptek produktów podrobionych, odrzuconych i niespełniających norm. Reguluje to norma branżowa OST 91500.05.0007.-2003 „Zasady wydawania (sprzedaży) leków w aptekach”. Strefy (pomieszczenia) przyjmowania i wydawania leków muszą być oddzielone od obszaru przechowywania i muszą zapewniać właściwą (niezawodną) ochronę przyjmowanych leków przed niekorzystnymi warunkami pogodowymi podczas operacji załadunku (rozładunku). Powstałe produkty podlegają przychodzącej kontroli jakości. Wyniki kontroli przychodzącej należy zarejestrować zgodnie z wynikami ustalonymi w placówce aptecznej zlecenie wewnętrzne. Podczas rozładunek produktów sprawdzić zgodność z zamówieniem oraz brak uszkodzeń opakowań lub kontenerów. Leki i inne towary dopuszczone do sprzedaży w aptekach, posiadające upływający termin ważności, niespełniające wymagań i norm jakościowych oraz nieposiadające dokumentów potwierdzających ich jakość, nie podlegają przyjęciu. Protokół sporządza się dla produktów leczniczych (produktów leczniczych) w opakowaniach uszkodzonych, które nie posiadają atestów i/lub niezbędnej dokumentacji towarzyszącej, które zostały odrzucone przy przyjęciu lub wydane pacjentowi, które są niezgodne z zamówieniem lub które posiadają wygasły; muszą być odpowiednio oznakowane i umieszczone w wyznaczonym miejscu, oddzielonym od innych produktów leczniczych do czasu ich zidentyfikowania, zwrócenia dostawcy lub usunięcia w razie potrzeby. Substancje trujące i silnie działające, środki odurzające, substancje psychotropowe, leki termolabilne należy natychmiast umieścić w miejscach przechowywania zgodnie z wymogami niniejszej OCTa.
Ilość przyjmowanych leków wymagających specjalnych warunków przechowywania musi odpowiadać dostępnej pojemności specjalistycznego sprzętu. Przyjęte leki i inne towary dopuszczone do wydania z aptek odbierane są w terminie wyznaczonym na przyjęcie towaru według liczby jednostek produktu i kompletności w przewidziany sposób. 6. Do każdej dostawy towaru należy dołączyć dokumenty pozwalające na ustalenie daty wysyłki, nazwy produktu leczniczego (w tym postaci dawkowania i dawkowania), numeru serii i partii, ilości dostarczonego towaru, ceny wydanego produktu leczniczego , nazwę i adres dostawcy i odbiorcy oraz dokumenty potwierdzające jakość produktów leczniczych. Dokumentami potwierdzającymi jakość leków są deklaracja zgodności lub certyfikat zgodności Ważny wskaźnik jest również to, że apteka lub sieć aptek Współpracują ze sprawdzonymi hurtowniami, znanymi firmami międzynarodowymi, które bardzo poważnie traktują własną „usługę bezpieczeństwa leków”.
Kontrola przyjęcia wraz ze sprawdzeniem poprawności dokumentów obejmuje sprawdzenie leków według wskaźników „Opis”, „Opakowanie”, „Oznakowanie”, które określają wymagania rozporządzenia Ministra Zdrowia Federacji Rosyjskiej z lipca 16, 1997. Nr 214 „W sprawie kontroli jakości leków wytwarzanych w organizacjach farmaceutycznych (aptekach)”. Kontrola na podstawie wskaźnika „Opis” obejmuje sprawdzenie wyglądu, koloru i zapachu. Niespójność koloru, obecność obcego zapachu, osadu, płatków, wtrąceń mechanicznych, zamarzania, rozwarstwiania są podstawą do odrzucenia. W przypadku wątpliwości co do jakości leków próbki przesyłane są do terytorialnego centrum kontroli jakości leków. Leki takie z oznaczeniem: „Odrzucone podczas kontroli przyjęcia” przechowywane są w aptece odizolowane od innych leków. Kontrola według wskaźnika „Opakowanie” obejmuje sprawdzenie integralności opakowania, obecności opakowania wtórnego oraz zgodności opakowania z właściwościami fizycznymi i chemicznymi leków.
2. Lokal i wyposażenie. Podstawowe wymagania dotyczące organizacji przechowywania leków i produktów celów medycznych w aptekach określają Instrukcje dotyczące organizacji przechowywania w aptekach różne grupy leki i artykuły medyczne. Leki wymagające specjalnych warunków przechowywania należy natychmiast zidentyfikować i przechowywać w odpowiednich warunkach pomieszczenia magazynowe (powierzchnie) zgodnie z wymogami obowiązującego prawodawstwa. Powierzchnia magazynu aptecznego musi być na tyle obszerna, aby zapewnić uporządkowane przechowywanie różnych kategorii materiałów i produktów. Czyste i chronione. Leki w produkcji magazyny należy składować na regałach, paletach, półkach, szafach chłodniczych i innych specjalny sprzęt zapewnienie warunków przechowywania leków zgodnych z obowiązującymi wymaganiami . Jeżeli w bazie aptecznej (magazynu) znajdują się leki immunobiologiczne, całkowita objętość urządzeń chłodniczych musi zapewniać, zgodnie z obowiązującymi wymaganiami, przechowywanie całej ilości tych leków znajdującej się w bazie (magazynu). Podczas przechowywania leków licencjobiorca ma obowiązek zapobiec ich uszkodzeniu (rozlanie, rozsypanie, stłuczenie), zanieczyszczeniu mikroorganizmami oraz zanieczyszczeniu krzyżowemu. Przechowywanie leków wymaga specjalnych warunków temperaturowych, kontrolowanych za pomocą urządzeń do ciągłego monitorowania temperatury lub pojemników termicznych.
3. Personel. W odniesieniu do zasobów obowiązuje trzecia zasada zarządzania – zaangażowanie pracowników. Podstawą organizacji są pracownicy wszystkich szczebli. Ich pełne zaangażowanie pozwala organizacji wykorzystać ich możliwości. Z jednej strony decyzja kierownictwa, że system zarządzania powinien funkcjonować, a z drugiej dopiero wtedy, gdy cały personel zda sobie sprawę, że system zarządzania to nie jest zwykły zbiór dodatkowych kartek papieru, który będzie stał na półce. To musi być skuteczna struktura i będzie działać tylko wtedy, gdy wszyscy zrozumieją, na czym się opiera i dlaczego się to robi. W każdej aptece, w takiej czy innej formie, stworzono system zarządzania jakością, który funkcjonuje z powodzeniem – dla niektórych wynosi on 10%, dla innych 90%.
4. Dokumentacja Czynności mające wpływ na jakość towaru muszą być opisane w pisemnych procedurach. System zarządzania jakością ma na celu usystematyzowanie procesów i sprawdzenie, czy wszystkie z nich są wyposażone w niezbędne zasoby i dokumenty. Ważne jest, aby wiedzieć, czy wszystkie procesy mają udokumentowane procedury i zasady realizacji. Aby podejmować decyzje zarządcze w oparciu o dowody, potrzebny jest proces analizy i doskonalenia – to siódma zasada zarządzania normami ISO. Skuteczne rozwiązanie opierają się na analizie danych i informacji.
7. Zwroty. Niedozwolona jest obecność w obrocie leków niskiej jakości lub sfałszowanych, z wyłączeniem tych, których data ważności minęła. Po stwierdzeniu faktu obecności leków niskiej jakości, sfałszowanych i podobnych, przedsiębiorca musi sporządzić odpowiednią ustawę i podjąć działania mające na celu wykluczenie ich z obrotu. Wykluczenie takich leków z obrotu następuje poprzez recykling i zniszczenie zgodnie z Regulaminem utylizacji leków. Dla specjalistów Centrum opracowano procedurę pracy z pismami Roszdravnador dotyczącymi odrzuconych i sfałszowanych produktów, zgodnie z wymaganiami i w formie określonej w piśmie Służba federalna do nadzoru w dziedzinie opieki zdrowotnej i rozwój społeczny z dnia 28.09.2004. Nr 4082/04.
5. Optymalizacja systemu zarządzania jakością działalność farmaceutyczną w aptece
W wyniku przestudiowania literatury dotyczącej zarządzania jakością farmaceutyczną można zaproponować optymalizację działań organizacji aptecznych poprzez wprowadzenie następujących zasad:
Jakość zarządzania jest pojęciem wieloaspektowym, obejmuje wiele elementów, takich jak przejrzystość i sterowalność procesów, jakość informacji, możliwość szybkiego monitorowania bieżących działań i wiele innych. Jednocześnie różne dokumenty są praktycznie jedynymi narzędziami zarządzania. Oczywistym sposobem na zmianę jakości zarządzania przedsiębiorstwem jest zatem zwiększenie efektywności pracy z dokumentami.
Zarządzanie jakością w aptece opiera się na następujące zasady:
Wystarczający asortyment i objętość przystępne ceny PO POŁUDNIU
Zadaniem apteki jest nic innego jak zaopatrywanie ludności w leki i leki towary farmaceutyczne V we właściwym miejscu iw dogodnym dla odwiedzających czasie, dla którego określa się potrzeby i dostawcę, sporządzany jest wniosek, przeprowadzany jest zakup i badane jest dawkowanie.
Dostępność społeczna
Prowadzenie badań asortymentu w granicach synonimów i analogów. W aptece występuje więcej niż jedna nazwa handlowa jednej substancji czynnej. Nazwy handlowe różnią się czasami o 100–700%, w zależności od producenta. Apteka dokonuje zakupów różnych nazw handlowych na różnych poziomach, aby zapewnić dostępność społeczną dla różnych grupy społeczne goście. W jednej grupie farmakoterapeutycznej można przyjmować leki drogie, średnio i tanie.
Wsparcie informacyjne i doradcze
Pracownicy apteki muszą przewidywać oczekiwania konsumentów i dbać o to, aby produkt spełniał te oczekiwania. Nie zawsze jest to możliwe. Na przykład konsument chce uzyskać poradę od farmaceuty przed zakupem leku. Farmaceuta nie jest jednak lekarzem i w naszym kraju nie ponosi ustawowej odpowiedzialności za zdrowie pacjenta. Jednak nie otrzymując tego, czego oczekiwał, konsument pozostaje niezadowolony.
Wdrażanie systemów komputerowych w aptekach i wykorzystanie kodów kreskowych do kontroli jakości leków w aptekach
System automatyzacji przedsiębiorstwa aptecznego różni się od systemów automatyzacji przedsiębiorstw detalicznych. Apteki mają wiele własnych cech, głównie związanych z cenami, co w Rosji zawsze było skomplikowanym i zagmatwanym procesem. Ceny w aptece są ustalane zgodnie z określonymi dokumentami prawnymi i są ściśle regulowane, istnieje lista leków, które nie są opodatkowane. Cena detaliczna takich leków jest ustalana inaczej. Wcześniej dla pracowników aptek proces odbioru towaru i ustalania cen był pracochłonny i czasochłonny. Dlatego automatyzacja jest tutaj po prostu niemożliwa.
Systemy automatyzacji umożliwiają pracownikom aptek przeglądanie danych o tym, co jest w magazynie, jakich leków nie ma w magazynie, a co należy dodatkowo kupić. Proces szybkiego podglądu sald rzeczywistych jest jednym z najważniejszych przy wyborze systemu automatyki.
W każdej zwykłej aptece, w której znajduje się prosta kasa fiskalna, dokonując zakupu, pieniądze, które wpłacamy do kasy, nie są w żaden sposób bezpośrednio powiązane z produktem, który otrzymujemy.
I tutaj od razu pojawia się kilka problemów:
Po pierwsze, w aptece brakuje pełnej i szczegółowej księgowości przepływu towarów i środków finansowych. Nie da się np. powiedzieć w danym momencie, ile danego produktu zostało sprzedane, ile pozostało parkiet handlowy lub w magazynie nie da się automatycznie zabronić dziurkowania towaru, którego już zabrakło itp.;
Po drugie, trudno uniknąć błędów, jakie może popełnić kasjer;
Po trzecie, brak szczegółowej księgowości nie pozwala na prowadzenie statystyk i szczegółowej analizy dynamiki sprzedaży, co uniemożliwia bardziej elastyczne reagowanie na zmiany popytu.
6. Analiza i sposoby doskonalenia systemu zarządzania jakością leków w aptece firmy MAIR LLC
MAIR LLC działa na rynku farmaceutycznym od ponad 15 lat na Terytorium Primorskim. Jej sieć aptek obejmuje 5 punktów sprzedaży detalicznej i cieszy się ogromną popularnością – karty posiada kilka tysięcy mieszkańców Władywostoku stali klienci. Zajmuje drugie piętro w 2-piętrowym budynku. Lokal apteki jest nowy, działa od maja 2010 roku, spełnia wszystkie wymogi NDT i norm sanitarnych, czynny jest w godzinach 9:00 - 20:00 siedem dni w tygodniu. Znajdują się tam tabliczki wskazujące nazwę apteki i godziny jej otwarcia. Zlokalizowany jest w dogodnej dla zwiedzających lokalizacji, w pobliżu przystanku autobusowego.
Mair za swoją główną misję uważa nie tyle sprzedaż leków, sprzedaż środków farmaceutycznych i leków, produktów medycznych, ale świadczenie usług farmaceutycznych dla wysoki poziom Dlatego firma stara się skupić na kliencie, zagwarantować jakość leków i jak najlepiej służyć kupującemu. Wszystko to, w połączeniu ze zrozumiałą chęcią usprawnienia swojej pracy, skłoniło kierownictwo do zastanowienia się nad wprowadzeniem systemu zarządzania jakością.
Apteka, pracując w systemie zarządzania jakością krócej niż rok, może wyciągnąć pewne wnioski. Obiektywne wskaźniki potwierdzają, że wprowadzenie systemu zarządzania jakością przyczyniło się do optymalizacji kapitału obrotowego: wzrósł wolumen sprzedaży w aptekach sieci, zmniejszyła się liczba towarów niskorentownych i niepłynnych oraz produktów przeterminowanych. Zwiększyła się liczba stałych klientów. Analiza ich potrzeb, życzeń i propozycji pozwoliła praktycznie pozbyć się usterek. Dodatkowo, dzięki skupieniu personelu na pracy z Klientem, znacząco wzrosła nie tylko liczba zakupów w Internecie, ale także ich średni koszt. Specjaliści ds. zarządzania jakością zauważają obecnie, że głównym i najbardziej problematycznym ogniwem każdej struktury zarządzania są ludzie. W naszym przypadku - specjaliści farmaceuci. Ci, którzy mają bezpośredni kontakt z klientami, gośćmi, konsumentami. W celu wdrożenia systemu zarządzania jakością w aptece dokonano zmian w strukturze organizacyjnej i relacjach wewnątrz zespołu. Efektywny system szkolenia personelu oraz stały monitoring szkoleń poprawiły jakość pracy personelu.
W wyniku analizy danych z literatury zagranicznej i krajowej ustalono, że kwestie systemu zarządzania jakością leków w instytucjach farmakologicznych, zarówno w Rosji, jak i za granicą, są omawiane duże skupienie. Studiując podstawowe koncepcje budowania modeli i funkcjonowania systemów zarządzania jakością, wyraźnym przywództwem są podejścia oparte na koncepcji kompleksowego zarządzania jakością (TQM) i normach serii ISO 9000, które dostarczają szeregu ogólne zasady: skupienie się na kliencie, przywództwo w zarządzaniu, podejście procesorowe, podejście systemowe, ciągłe doskonalenie, wzajemnie korzystne relacje z dostawcami itp.
System zarządzania jakością w zakresie obrotu lekami w Rosji określa ustawa federalna nr 86 „O lekach” Zarządzanie jakością w organizacjach farmaceutycznych opiera się na zasadach TQM i standardach serii ISO 9000 oraz. standardy branżowe: OST91500.05.0005-2002 „Zasady hurtowego obrotu lekami. Przepisy podstawowe”, zatwierdzone zarządzeniem Ministra Zdrowia Federacji Rosyjskiej z dnia 15 marca 2002 r. nr 80; OST 91500.05.0007-2003.
Zgodnie z międzynarodową praktyką apteka ponosi pełną odpowiedzialność za jakość produktów zakupionych od dostawców, jedynie obowiązkowe wymagania dotyczące produktów są określone przez prawo, a wszystkie pozostałe warunki są określone w umowie pomiędzy uczestnikami rynku.
System zarządzania jakością w zakresie obrotu lekami musi mieć charakter rzetelny, prewencyjny, zapobiegający świadczeniu konsumentowi usług farmaceutycznych poniżej standardów, a także spersonalizowany, tj. mają za to konkretne osoby odpowiedzialne.
Rozważa się pewne zasady, które pozwalają na optymalizację systemu zarządzania jakością w zakresie obrotu lekami w aptekach.Studiując literaturę dotyczącą zarządzania jakością produktów farmaceutycznych, można zaproponować optymalizację działań organizacji aptecznych poprzez wprowadzenie poniższych zasad.
BIBLIOGRAFIA
Zarządzenie Ministra Zdrowia Federacji Rosyjskiej z dnia 4 marca 2003 r. Nr 80 „W sprawie zatwierdzenia normy branżowej „Zasady wydawania (sprzedaży) leków w aptekach. Przepisy podstawowe”.
Skulkova R.S., Yagudina R.I., Parkhomenko D.V. Stworzenie systemu zarządzania jakością dla organizacji farmaceutycznych. Nowa apteka. Przepisy prawne. 2005.-N 4.-P.32-37 .
Komisska I. G. Nowoczesna koncepcja zarządzanie jakością organizacji aptecznej // Apteki w Moskwie. – 2007 r. – nr 11.
Alferova, T.V. Zarządzanie produkcją w przedsiębiorstwach przemysłu farmaceutycznego / T.V. Alferova, E.A. Tretyakova, A.V. Builin. – Jekaterynburg: Wydawnictwo Instytutu Ekonomii Oddziału Uralskiego Rosyjskiej Akademii Nauk, 2008. – 214 s.
Moskvin V.A. Ewolucja w dziedzinie zarządzania jakością / V.A. Moskvin // Inwestycje w Rosji 2004. nr 5.- s. 27-28.
Łagutkina T.P. P zasady zarządzania jakością w działalności organizacji aptecznej // Biuletyn Uniwersytetu Przyjaźni Narodów Rosji. 2008.-N 4.-P.36-39.
Poleski V.A. Ewolucja modeli systemów jakości: praktyka międzynarodowa / V.A. Poleski, SA Martynchik, V.G. Zaporożenko, V.Z. Kucherenko // Ekonomika opieki zdrowotnej. - 2005. - nr 8. - s. 25-36.
prawo federalne„O lekach” nr 86-FZ z dnia 22 czerwca 1998 r
Drugova Z.K., Biteryakova A.M. System kontroli wewnętrznej i zarządzanie jakością // Apteki rosyjskie. – nr 2. – 2007.
Kononova S.V. System zapewnienia jakości usług farmaceutycznych w regionalnym kompleksie farmaceutycznym: Monografia. -Niżny Nowogród: Wydawnictwo VGIPA, 2003.
Warunki przechowywania leków. – M.: Medycyna, 2006. – 184 s.
Kulaev V.A. Egorov V.A., Gladunova E.P., Ezhkov V.N. Zintegrowany system zarządzania jakością w opiece farmaceutycznej // Apteka, 2011, nr 3, s. 30-33
GOU VPO „AKADEMIA FARMACEUTYCZNA PAŃSTWA PERM”
Katedra Zarządzania i Ekonomiki Farmacji FDPO i FZO
Zaawansowane szkolenia w formie kursów korespondencyjnych
wykorzystanie technologii zdalnych na specjalności „Zarządzanie i Ekonomika Farmacji”
Czas trwania szkolenia (od 15.10.2010 do 14.09.2011)
Praca na kursie w tym temacie:
“Stworzenie systemu zarządzania jakością leków w aptece ”
WYKONAWCA:
Fadeeva Maria Valerievna, farmaceuta-stażysta
Baza badawcza:
Apteka „MAIR”
Miasto Władywostok
Perm 2011
Wstęp
1. Stan aktulany systemy zarządzania jakością leków w działalności apteki w obce kraje…………....……5
2. Ramy prawne zarządzanie jakością leków w organizacjach farmaceutycznych zgodnie z literaturą i dokumentami regulacyjnymi ………………………………………………………………..…..10
3. Zarządzanie działalnością farmaceutyczną w aptece…………………12
4. Stworzenie systemu zarządzania jakością leków w aptece ……………………………………………………………………………….....17
5. Optymalizacja systemu zarządzania jakością działalności farmaceutycznej w aptece……………………………………………………………...….22
6. Analiza i sposoby doskonalenia systemu zarządzania jakością leków w aptece MAIR LLC …………………...……23
Wnioski…………………………………………………………………………………..…25
Wykaz wykorzystanej literatury………………………………………..26
WSTĘP
Społeczna orientacja rynku farmaceutycznego, zaspokajająca zapotrzebowanie na leki niezbędne do życia, a co za tym idzie potrzebę zachowania i poprawy zdrowia, powoduje konieczność opracowania systemu zarządzania jakością wprowadzanych na rynek towarów i usług farmaceutycznych. Podstawą tego systemu jest system zarządzania jakością leków na wszystkich etapach ich wytwarzania koło życia oraz jakość opieki farmaceutycznej jako działalności mającej na celu świadczenie usług farmaceutycznych ludności. Jakość leków na poziomie federalnym jest prawnie zdefiniowana jako zgodność ze standardem stanowym.
Współczesne funkcjonowanie rosyjskiego rynku farmaceutycznego charakteryzuje się stale poszerzającą się ofertą leków i nieproporcjonalnie dużą liczbą dostawców. W tych warunkach szczególnie istotny staje się problem zapewnienia jakości opieki medycznej świadczonej ludności. Zgodnie z wymogami aktualnej normy branżowej „Zasady wydawania (sprzedaży) leków w aptekach. Podstawowe postanowienia” w każdej organizacji aptecznej prowadzącej sprzedaż detaliczną leków należy stworzyć system zarządzania jakością. Wynika to ze szczególnej odpowiedzialności zawodowej za jakość opieki medycznej przypisanej aptekom. Dzisiaj jest cała linia publikacje w czołowych wydawnictwach farmaceutycznych, różnych sektorach gospodarki, ale niestety w farmacji zarządzanie jakością i działalność rzecznika ds. jakości mylone są z wykonywaniem obowiązków funkcjonalnych farmaceuty-analityka.
Jeśli w branży system zarządzania jakością jest wprowadzany od dawna, to w działalności organizacji farmaceutycznej dopiero zaczyna on żyć i działać. Jak dotąd nie ma (udokumentowanych) zaleceń dotyczących wdrożenia systemu w organizacjach aptecznych, który powinien być zbudowany w oparciu o międzynarodowe standardy jakość
Pojęcie jakości obejmuje relację pomiędzy producentem a konsumentem produktu. Produkt jest na tyle wysokiej jakości, że zaspokaja potrzeby i wymagania konsumenta. Główne właściwości jakości to: nierozerwalność z przedmiotem (jeśli mówimy o sieci detalicznej, to jakość musi być obecna w każdym miejscu); niespójność w czasie, nie da się raz zmierzyć jakości, ponieważ czynniki wpływające zmieniają się i odpowiednio zmienia się jakość (na przykład przybył nowy personel, wzrosło obciążenie pracą, a w rezultacie zmieniła się jakość). Formułę jakości można wyrazić następująco: stosunek postrzeganych cech usług do cech usług oczekiwanych przez klienta. Jakość jest maksymalna, jeśli jej wskaźnik jest równy jeden.
Wprowadzenie systemu zarządzania jakością działalności farmaceutycznej zgodnego z międzynarodowymi wymaganiami pozwala nam na odejście od licencjonowania działalności farmaceutycznej. Ważniejsze jest posiadanie licencji specjalisty. Jeżeli w działalności prowadzonej przez specjalistę dojdzie do naruszeń, zostaje on pozbawiony licencji, a przedsiębiorstwo kontynuuje działalność.
Oprócz, nowoczesna scena Rozwój rosyjskiego rynku farmaceutycznego charakteryzuje się lawinowym wzrostem gamy leków wprowadzanych na rynek po raz pierwszy. Pozwala to z jednej strony lekarzowi, przy wystarczającej świadomości zawodowej w zakresie dostępności ofert i właściwości leków, na wybór optymalnego dla danej choroby schematu farmakoterapii, z drugiej zaś komplikuje samą procedurę selekcji ze względu na wiele kryteriów wyboru optymalnego leku. Farmaceuta zajmujący się sprzedażą leków, udzielając konsumentom pomocy doradczej, także często spotyka się z pewnymi trudnościami wynikającymi z niedostatecznej świadomości właściwości farmakoekonomicznych nowych leków. Aby specjalista mógł odpowiedzieć nowoczesne standardy i wymagań, konieczne jest jasne określenie stopnia jego odpowiedzialności za przydzieloną pracę. Dokładnie poziom profesjonalny specjalista powinien stać się jednym z głównych elementów systemu zarządzania jakością w przedsiębiorstwie aptecznym.
Dlatego celem tej pracy jest zbadanie teoretycznych i praktycznych podejść do tworzenia systemu zarządzania jakością leków w aptece, a także analiza pojawiających się problemów i opracowanie sposobów ich rozwiązania.
Realizacja tego celu wymaga rozwiązania następujących zadań:
1. Studium aktualnego stanu systemu zarządzania jakością leków w działalności apteki za granicą i Federacji Rosyjskiej
2. Rozważanie podstawy teoretyczne systemy zarządzania jakością leków w organizacjach aptecznych zgodnie z literaturą i dokumentami regulacyjnymi.
3. Optymalizacja systemu zarządzania jakością działalności farmaceutycznej w aptece.
4. Analiza zarządzania jakością leków w aptece MAIR we Władywostoku.
Metodologia badań opiera się na konstytucyjnych zasadach gwarancji państwowych ochrony zdrowia obywateli, aktach ustawodawczych i regulacyjnych Federacji Rosyjskiej w dziedzinie opieki zdrowotnej i dostarczanie leków, Koncepcja WHO dotycząca polityki państwa w zakresie podaży leków, prace naukowe autorów krajowych i zagranicznych z zakresu zarządzania i ekonomiki farmacji oraz opieki zdrowotnej i zarządzania farmaceutycznego. Do napisania pracy wykorzystano także literaturę dydaktyczną z zakresu dyscypliny, artykuły z czasopism specjalistycznych oraz źródła internetowe.
1. Aktualny stan systemu zarządzania jakością leków w działalności aptek za granicą
Opracowując własną politykę narodową w zakresie podaży narkotyków, Rosja musi w jak największym stopniu uwzględniać przyjęte wymagania międzynarodowe. Specjalne zarządzenie Prezydenta Rosji W.W. Putina wydane we wrześniu 2003 roku podkreśla potrzebę harmonizacji aktów prawnych Federacji Rosyjskiej w zakresie obrotu lekami z normami przyjętymi w praktyce międzynarodowej. W Ustawie Zasadniczej z 1998 r., a później w 2003 r., w 80. normie branżowej, takie pojęcia jak apteka (w tym apteka szpitalna), apteka zakładu opieki zdrowotnej, apteka, sklep apteczny i kiosk apteczny nazywano „apteką”. zakładów.” Tak naprawdę na dzisiejszym rynku farmaceutycznym istnieją dwa rodzaje organizacji farmaceutycznych - instytucje apteczne powiązane z handlem detalicznym i inne - organizacje handlu hurtowego lekami.
I.G. Komissinskaya (2007) szczegółowo zbadała współczesną koncepcję zarządzania jakością w organizacjach farmaceutycznych na świecie. Organizacją międzynarodową pomagającą w opracowywaniu powszechnie przyjętych norm, zasad i innych podobnych dokumentów w celu ułatwienia międzynarodowej wymiany towarów i usług jest ISO – Międzynarodowa Organizacja Normalizacyjna. ISO to skrót od greckiego słowa isos, oznaczającego „uniwersalny”. Ważne jest, aby zrozumieć, czym są normy ISO, dlaczego regulują wymagania na całym świecie oraz dostarczają podstawowych przepisów i koncepcji z zakresu systemu zarządzania jakością.
Historia powstania norm ISO 9000 związana jest z przyjętą w UE Globalną koncepcją legislacyjnego zapewniania jakości towarów i usług, która obejmuje: system zarządzania jakością producenta; badanie produktów w laboratoriach badawczych; Certyfikacja produktu; stosowanie systemu zarządzania jakością w organizacjach jako gwarancji stabilnej jakości produktów i usług.
Światowe doświadczenia w organizacji pracy w obszarze zarządzania jakością podsumowane i usystematyzowane są w normach serii ISO 9000 – jest to pakiet dokumentów dotyczących zapewnienia jakości przygotowany przez 176. Komitet Międzynarodowej Organizacji Normalizacyjnej.
Zgodnie z praktyką międzynarodową, ustawa określa jedynie obowiązkowe wymagania dotyczące produktów, a wszystkie pozostałe warunki określa umowa pomiędzy uczestnikami rynku, tj. Apteka ponosi pełną odpowiedzialność za jakość produktów zakupionych od dostawców. Normy serii ISO 9000 stanowią międzynarodowy punkt odniesienia w zakresie wymagań jakościowych w działalności komercyjnej. Ich głównym celem jest pomoc aptekom w identyfikacji potencjalnych dostawców posiadających skuteczny system zarządzania jakością; redukcja kosztów jakości dzięki zaufaniu do jakości dostawcy; pomoc i pomoc metodyczna organizacjom w tworzeniu systemów jakości. Do najważniejszych z nich należą: ISO 9000-2001, które nazywane jest „Systemem Zarządzania Jakością”. Podstawy i słownictwo” to podstawowy standard, na którym opiera się cała terminologia i koncepcje. Jego logiczną kontynuacją jest GOST R ISO 9001-2001, który nazywa się „Systemem zarządzania jakością”. Wymagania". Obecnie w praktyce światowej istnieje ponad 20 norm ISO.
Przez jakość leków rozumie się ich zgodność ze wszystkimi warunkami rejestracji, warunkami produkcji (technologia, miejsce produkcji, personel) i określonymi cechami. Produkty farmaceutyczne, jak każdy inny produkt, przechodzą przez różne etapy cyklu życia (pętle jakości) (ryc. 1).
Ryż. 1. System zapewnienia jakości leków
Obecnym światowym trendem w zakresie standaryzacji i regulacji produkcji leków jest globalne ujednolicenie wymagań dotyczących produkcji leków w całym cyklu życia leku i nacisk na zadowolenie konsumenta zgodnie z przeznaczeniem leku (ryc. 2).
Kiedy produkt leczniczy trafia na rynek z przedsiębiorstwa, otrzymuje certyfikat jakości podpisany przez osoba upoważniona producenta, jeśli spełnia wskaźniki jakości dokumentacji rejestracyjnej w zakresie bezpieczeństwa, skuteczności i jest produkowany zgodnie z zasadami GMP.
Jednocześnie wyraźnie wyrażone są dwa kierunki – rosnąca odpowiedzialność społeczna producenta leku, narzucana przez państwo i społeczeństwo jako całość oraz nacisk na zapewnienie wydajności produktu odpowiedniej jakości poprzez działania organizacyjne i zarządcze na wszystkich etapach – od opracowania nowego leku po wdrożenie ukończony produkt– z aktywną rolą regulacyjną agencji rządowych.

Ryż. 2. Podstawowe wymagania WHO dotyczące jakości leków
Wynik prac komitetu wykonawczego ds ten moment było opracowanie i przyjęcie dokumentów związanych z procesem tworzenia leków (Q8 „Rozwój farmaceutyczny”), zarządzaniem ryzykiem jakościowym (Q9 „Zarządzanie ryzykiem jakościowym”) oraz systemem jakości (Q10 „Systemy jakości farmaceutycznej”) (rys. 3) .
Następnie z perspektywy standardów ISO zastanowimy się, czym zajmuje się organizacja apteczna, kto jest zainteresowany czym i jak uczynić tę działalność bardziej efektywną i wydajną. Koncepcja zapewniania jakości farmaceutycznej daje możliwość lepszego zrozumienia, uznania i wypełnienia obowiązków nałożonych na wszystkich praktykujących farmaceutów. Dobra praktyka farmaceutyczna (GPP) to działania związane z dostarczaniem, przechowywaniem i stosowaniem leków i wyrobów medycznych prowadzone w aptekach.
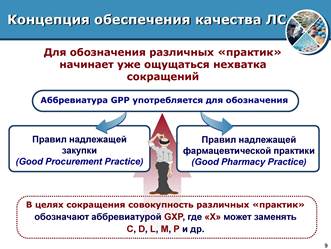
Ryc.3. Zasady dobrej praktyki farmaceutycznej w zapewnieniu jakości leków
Inicjatorami działań normalizacyjnych są krajowe organy regulacyjne w ścisłej współpracy z producentami reprezentowanymi przez stowarzyszenia farmaceutyczne.
Norma ISO i certyfikat ISO to dwa nierozłączne pojęcia. Oczywiście można wdrożyć system ISO bez jego certyfikowania, ale kto sprawdzi, jak poprawnie jest on zbudowany? W w tym przypadku Istnieje dokument zwany „Certyfikatem ISO 9000”, który potwierdza zgodność systemu zarządzania jakością organizacji z ustalonymi wymaganiami. Certyfikat leku to dokument potwierdzający jakość leku. Certyfikat ISO jest dokumentem potwierdzającym zgodność systemu zarządzania jakością z wymaganiami nałożonymi przez odpowiednie GOST. Mówiąc o systemie zarządzania jakością, nie można nie wspomnieć o normach ISO.
Główne zapisy systemu zarządzania jakością opisuje norma ISO 9000. Formułuje ona 8 zasad zarządzania jakością:
1. Skoncentrowanie się na konsumencie: zrozumienie jego obecnych i przyszłych potrzeb, spełnienie jego wymagań i dążenie do przekroczenia jego oczekiwań.
2. Przywództwo menedżera zapewniające jedność celu i kierunku organizacji.
3. Zaangażowanie pracowników, umożliwiające opłacalne wykorzystanie ich umiejętności.
4. Procesowe podejście do zarządzania działaniami i związanymi z nimi zasobami.
5. Systemowe podejście do zarządzania: identyfikacja, zrozumienie i zarządzanie wzajemnie powiązanymi procesami jako system przyczynia się do efektywności i efektywności organizacji w osiąganiu jej celów.
6. Ciągłe doskonalenie działalności organizacji.
7. Podejmowanie decyzji w oparciu o analizę danych i informacji.
8. Obustronnie korzystne relacje z dostawcami.
Osiągnięcie celów jakościowych może mieć pozytywny wpływ na jakość produktu, efektywność operacyjną i wyniki finansowe, a w konsekwencji na satysfakcję i zaufanie interesariuszy.
Do głównych zapisów systemu zarządzania jakością należy dokumentacja, która pozwala przekazać znaczenie i kolejność działań.
Obecnie nie oczekuje się już, że będzie to zapewniać tylko jakość produktu i dostawa cel zadowolenie konsumentów poprzez spełnianie i przekraczanie ich wymagań poprzez wdrażanie skutecznych systemów zarządzania jakością, ciągłe doskonalenie jego efektywności, a także zapobieganie rozbieżnościom pomiędzy oczekiwaniami konsumentów a jakością oferowanych im produktów i usług.
Za najbardziej metodologicznie mocny, efektywny i popularny uznawany jest obecnie model kompleksowego zarządzania jakością (Total Quality Management – TQM), który opiera się na realizacji takich zasad jak: koncentracja na kliencie, przywództwo menadżerskie, zaangażowanie całego personelu w rozwiązywanie problemów jakościowych , systemowe i podejście procesowe do zarządzania, ciągłego doskonalenia produkcji, wzajemnie korzystnej współpracy, podejmowania decyzji w oparciu o fakty.
2. Ramy prawne zarządzanie jakością leków w organizacjach aptecznych zgodnie z literaturą i dokumentami regulacyjnymi
Ważne jest, aby wziąć pod uwagę, jakie podstawowe standardy istnieją w Rosji, które z nich zapewniają dekodowanie podstawowych pojęć i definicji, który standard nakłada wymagania w procesie certyfikacji organizacji i systemie zarządzania jakością. Rosja uczestniczy w działaniach ISO Agencja rządowa- Gosstandart Rosji.
W związku z integracją ze społecznością światową brany jest pod uwagę i wdrażany w Rosji zestaw norm ISO, gdzie na podstawie tych norm opracowano:
GOST R ISO 9000-2001 opisuje główne postanowienia i zawiera terminologię związaną z systemem zarządzania jakością.
GOST R ISO 9001-2001 określa wymagania dotyczące systemu zarządzania jakością
Norma (GOST R ISO 9004-2001) nosi nazwę „System zarządzania jakością”. Zalecenia dotyczące ulepszenia działań.” Normy 9001 i 9004 mają całkowicie identyczną strukturę, ale norma 9001 jest jaśniejsza i bardziej zwięzła. Norma 9004 jest w pewnym sensie oparta na normie 9001 i zawiera te same sekcje, ale w rozszerzonej formie, z objaśnieniami i dodatkami. Zastanawia się nie tylko jak stworzyć system zarządzania jakością, uzyskać dla niego certyfikat ISO, ale także wykorzystać go do doskonalenia działań organizacji. Wszystkie trzy wyznaczone standardy są ze sobą ściśle powiązane.
Obecny system zarządzania jakością został opracowany i wdrożony ściśle według wymagań krajowych norm Federacji Rosyjskiej GOST R 52249–2009 (GMP) „Zasady produkcji i kontroli jakości leków” oraz GOST R ISO 9001–2008 (ISO 9001:2008) „Systemy zarządzania jakością. Wymagania".
Rosyjski standard GMP został przygotowany przez Stowarzyszenie Inżynierów Kontroli Mikrozanieczyszczeń (ASINCOM). W 2004 r. Został zatwierdzony uchwałą Państwowego Standardu Rosji z 10 marca 2004 r. Nr 160-st GOST R 52249-2004 „Zasady produkcji i kontroli jakości produktów leczniczych”, co jest zharmonizowane z GMP ( Dobra Praktyka Wytwarzania Produktów Leczniczych) przepisy Unii Europejskiej. Zarządzenie Ministerstwa Zdrowia i Ministerstwa Gospodarki weszło w życie 1 stycznia 2005 roku i przestrzeganie zasad GMP w produkcji farmaceutycznej w Federacji Rosyjskiej jest obowiązkowe.
Zapewnienie jakości leków jest jednym z najważniejszych zadań współczesnej farmacji. Za standaryzację i ujednolicenie procesu zapewnienia jakości leków na etapie ich bezpośredniego odbioru do pacjentów (detaliczne ogniwo dystrybucji leków) uznaje się niezbędne użycie zasady i metody standardów Dobrej Praktyki Farmaceutycznej (GPP). Z punktu widzenia norm ISO organizacja apteki to grupa pracowników i niezbędne fundusze z podziałem odpowiedzialności, uprawnień i powiązań prowadzących działalność farmaceutyczną w obiektach farmaceutycznych takich jak apteka, punkt, kiosk, sklep itp. .
Niezbędnym warunkiem prowadzenia działalności farmaceutycznej jest zapewnienie jakości w przedsiębiorstwach handlu hurtowego i organizacjach farmaceutycznych, co znajduje odzwierciedlenie w OST. Pierwszy krok do stworzenia nowoczesnego ramy prawne regulacja rynku farmaceutycznego z uwzględnieniem standardów międzynarodowych polega na przyjęciu następujących standardów branżowych:
OST91500.05.0005-2002 „Zasady hurtowego obrotu lekami. Przepisy podstawowe”, zatwierdzone zarządzeniem Ministra Zdrowia Federacji Rosyjskiej z dnia 15 marca 2002 r. nr 80;
OST 91500.05.0007-2003 „Zasady wydawania (sprzedaży) leków w aptekach. Przepisy podstawowe”, zatwierdzony rozporządzeniem Ministerstwa Zdrowia Federacji Rosyjskiej z dnia 04.03.2003 nr 80.
3. Systemy zarządzania jakością działalności farmaceutycznej w aptekach
Problematyka stworzenia skutecznego systemu zarządzania jakością leków (leków) w aptekach znajduje odzwierciedlenie w publikacjach szeregu krajowych naukowców: D.V. Parkhomenko, I.G. Komisińska, Z.K. Drugova, A.M. Biteryakova, S.V. Kononova i in.
System to zbiór wzajemnie powiązanych i oddziałujących na siebie zasad. Każdy system posiada tzw. wejście – czyli procesy i wartości materialne inicjujące działania; w systemie zachodzą jego własne procesy. System zarządzania jakością w sferze obrotu lekami w Rosji określa ustawa federalna nr 86 „O lekach”, a jego główne etapy to rejestracja produktu leczniczego, licencjonowanie wytwarzania produktu leczniczego i licencjonowanie działalności farmaceutycznej .
Zgodnie z art. 45 tej ustawy na pracownikach apteki ciąży szczególna odpowiedzialność zawodowa za zapewnienie konsumentowi wysokiej jakości opieki medycznej. Szkody związane z uszczerbkiem na zdrowiu powstałe w wyniku stosowania leków, które stały się bezużyteczne w wyniku naruszenia zasad działalności farmaceutycznej, rekompensuje organizacja, z winy której doszło do naruszenia.
Złożoność, wieloetapowość i czas trwania „cyklu życia leku” – od ich powstania do otrzymania przez konsumenta końcowego – przesądzają o konieczności wprowadzenia skutecznego systemu prewencyjnego zarządzania jakością leków, który zapobiega przedostawaniu się na rynek farmaceutyczny leków niespełniających norm . Ostatnim ogniwem, w którym jakość leków oceniają wykwalifikowani specjaliści, na drodze leku od producenta do konsumenta, jest apteka. Zarządzanie jakością organizacji farmaceutycznych opiera się na zasadach TQM i norm serii ISO 9000.
W apteki należy stworzyć system zarządzania jakością, którego jedną z funkcji jest kontrola zgodności z wymaganiami dokumentów regulacyjnych systemu normalizacji w opiece zdrowotnej, w szczególności ww. OST. Głównym celem stworzenia skutecznego systemu zarządzania jakością leków (leków) i działalnością farmaceutyczną w aptece jest zapewnienie konsumentom możliwości zakupu dobrej jakości leków i otrzymania wysokiej jakości usług lekowych .
OST 91500.05.0007-2003 „Zasady wydawania (sprzedaży) leków w aptekach, podstawowe przepisy” (zatwierdzone rozporządzeniem Ministerstwa Zdrowia Rosji) reguluje zasady sprzedaży detalicznej w aptekach, sekcja 9, paragraf 9.1 stwierdza : „Organizacja apteki musi posiadać system zarządzania jakością”. Punkt 9.9 stanowi: „Kierownik organizacji aptecznej wyznacza przedstawiciela ds. jakości spośród kadry kierowniczej”.
Usługi farmaceutyczne mają dużą wartość konsumencką, gdyż stanowią jeden z rodzajów usług intelektualnych, które pomagają zachować i chronić zdrowie ludzkie. Wysokie koszty konsumenckie przesądzają o zasadności wysokich cen tych usług.
Wyniki usług są z reguły opóźnione i zróżnicowane, co determinuje specjalne podejście do kształtowania cen usług i specjalnego reżimu finansowania organizacji farmaceutycznych. Konsumentem usług farmaceutycznych jest zarówno jednostka, jak i społeczeństwo jako całość.
Cechy te determinują dwoiste podejście do problemu jakości usług farmaceutycznych. Po pierwsze, poprawa jakości jest jednym z głównych czynników przewagi konkurencyjnej organizacji farmaceutycznej i maksymalnego zysku. Dlatego problem jakości usług farmaceutycznych zaczyna znajdować się w centrum interesów ekonomicznych organizacji i umożliwia wzmocnienie jej stabilności ekonomicznej. Z drugiej strony jakość usług farmaceutycznych jest najważniejszy warunek spełniając swoją funkcję społeczną – zapewniając wysokiej jakości opiekę farmaceutyczną, a docelowo utrzymując zdrowie ludzkie. Organizacja farmaceutyczna może uznać, że osiągnęła swoje cele i zadania tylko wtedy, gdy zapewniła wysoki poziom jakości świadczonych usług. Dlatego konieczne jest wypracowanie w organizacji systemu jakości, a raczej systemu zarządzania jakością.
Na jakość usług farmaceutycznych składają się dwa główne elementy: jakość leków (leków) I jakość działalności farmaceutycznej.
Jakość leków określone przez następujące elementy :
Określanie potrzeb rynku (jakość wyboru konsumenta);
Jakość projektowania leków;
Jakość procesu produkcyjnego;
Zgodność jakości produktu końcowego z projektem;
Jakość obsługi posprzedażnej.
Do głównych właściwości decydujących o jakości wyrobów farmaceutycznych i medycznych zalicza się:
bezpieczeństwo- stan towaru w normalne warunki jego użytkowania, przechowywania, transportu i usuwania, w którym ryzyko zagrożenia życia, zdrowia i mienia konsumenta jest ograniczone do akceptowalnego poziomu.
Właściwości funkcjonalne . Określają przydatność produktów do pełnienia zamierzonych funkcji w danych warunkach eksploatacji lub zużycia.
N niezawodność. W wielu przypadkach o bezpieczeństwie produktu decyduje jego niezawodność, tj. właściwość utrzymywania swoich pierwotnych właściwości przez długi czas w określonych granicach podczas pracy.
przyjazność dla środowiska. Charakteryzuje stopień Szkodliwe efekty artykuły medyczne dla środowisko powstające w trakcie całego życia produktu. Wskaźniki środowiskowe: poziom emisji niebezpiecznych substancji chemicznych, promieniowanie, stężenie szkodliwe substancje, a także możliwość recyklingu.
estetyka- wskaźnik jakościowej i ilościowej oceny wartości estetycznej produktów w zależności od grupy konsumentów, specyficznych warunków konsumpcji i przeznaczenia produktu.
zużycie zasobów. Charakteryzuje się kosztami konsumenta związanymi z nabyciem, eksploatacją i utrzymaniem produktu w okresie przeciętnego zasobu technicznego, tj. przed wycofaniem produktu z użytku.
Ocena jakości leków
Jakość leków ocenia się zgodnie z Instrukcją oceny jakości leków wytwarzanych w aptekach (rozporządzenie Ministerstwa Zdrowia Rosji z dnia 16 października 1997 r. Nr 305) „W sprawie norm dopuszczalnych odchyleń w produkcji leków i pakowania produktów przemysłowych w aptekach”). Zarządzenie to dotyczy wszystkich aptek, punktów aptecznych (posiadających uprawnienia do wytwarzania leków) oraz terytorialnych laboratoriów kontrolnych i analitycznych, które monitorują jakość leków wytwarzanych w aptekach.
Jakość leków (w tym homeopatycznych) wytwarzanych w aptekach określana jest na podstawie zestawu wskaźników. Poziom jakości leków ocenia się zgodnie z wymogami regulowanymi przez aktualny Globalny Fundusz, zarządzeniami i instrukcjami rosyjskiego Ministerstwa Zdrowia.
Aby ocenić jakość, stosuje się określenia „Spełnia wymagania” („Dobry produkt”) i „Nie spełnia wymagań” („Wadliwy”). Poziom jakości wytwarzanych leków określany jest metodami organoleptycznymi i pomiarowymi.
O niezadowalającej jakości wytwarzanych leków decydują następujące wskaźniki:
· rozbieżność w opisie ( wygląd, kolor, zapach);
· rozbieżność w przezroczystości lub kolorze;
· rozbieżność w rozpadzie;
· niejednorodność mielenia lub mieszania proszków, maści, czopków, rozcierań homeopatycznych;
· obecność widocznych wtrąceń mechanicznych;
· niezgodność z zeszytem pod względem autentyczności;
· błędna zamiana jednego leku na inny, brak przepisanej substancji lub obecność nieprzepisanej substancji;
· zastąpienie leków podobnymi działanie farmakologiczne bez wskazania tego zamiennika na żądanie, przepis (kopia przepisu, etykieta);
· odchylenia od receptury w zakresie masy lub objętości;
· odchylenia masy całkowitej (objętości);
· odchylenia w masie poszczególnych dawek i ich ilości;
· odchylenia w masie próbki (lub stężeniu) poszczególnych leków;
· rozbieżność wartości pH;
· rozbieżność w gęstości;
· niespójność w sterylności;
· rozbieżność w czystości mikrobiologicznej;
· naruszenie trwałości zamknięcia (w przypadku sterylnych postaci dawkowania);
· Naruszenie zasad rejestracji leków przeznaczonych do dopuszczenia do obrotu.
Zmiany w składzie leku (jeśli to konieczne) należy wprowadzać wyłącznie za zgodą lekarza i należy je odnotować na wniosku, recepcie (kopia recepty, etykieta). W przypadku braku określonego znaku na wymogu, przepisie (kopia przepisu, etykieta) jakość wykonania postaci dawkowania ocenia się jako „Niezadowalająca”.
Zmiany w ilości wydawanych leków lub wydaniu tabletek zamiast proszków należy także odnotować na wniosku, recepcie itp.
Przy określaniu odchyleń w badanych postaciach dawkowania należy stosować przyrządy pomiarowe tego samego typu (o takich samych właściwościach metrologicznych), jak wtedy, gdy były produkowane w aptekach.
Ustalono standardy odchyleń, które są dopuszczalne przy wytwarzaniu produktów leczniczych (w tym homeopatycznych) w aptekach (zarządzenie Ministerstwa Zdrowia Rosji z dnia 16 października 1997 r. nr 305).
Przy określaniu dopuszczalnych odchyleń w badanych lekach, wytwarzanych w postaci serii preparatów aptecznych, należy kierować się powyższymi normami odchyleń, a także aktualną dokumentacją normatywną regulującą produkcję i kontrolę jakości różnych postaci farmaceutycznych w aptekach.
Jakość działalności farmaceutycznej
Rynek usług farmaceutycznych ma jasno określone granice terytorialne. W funkcjonowaniu rynku farmaceutycznego konieczna jest kontrola państwa, gdyż usługi farmaceutyczne są dobrem publicznym i należy unikać ich monopolizacji. Państwo pełni funkcje związane przede wszystkim z regulacją prawną, wsparciem informacyjnym i innymi aspektami rozwoju rynku. Można zatem mówić o pewnej dwoistości usług farmaceutycznych. Z jednej strony reprezentują produkt, który ma swoją wartość konsumencką i może być przedmiotem relacji rynkowych. Wdrożenie w tym przypadku musi mieć charakter komercyjny i zmierzać do uzyskania maksymalnego zysku.
Z drugiej strony usługi farmaceutyczne są dobro publiczne których charakterystycznymi cechami są niepodzielność, wspólna konsumpcja, duże znaczenie społeczne oraz przewaga własności publicznej i państwowej w ich produkcji i konsumpcji. Z punktu widzenia konsumenta organizacje farmaceutyczne świadczą kompleksowe usługi, zaspokajając najważniejsze potrzeby społeczne zarówno jednostki, jak i społeczeństwa jako całości. Ważna funkcja jest także to, że świadczenie usług farmaceutycznych wymaga przestrzegania określonych norm moralnych i etycznych. To wszystko utrudnia ujęcie ilościowe działalności, co ogranicza stosowanie komercyjnych zasad działania w działalności farmaceutycznej.
Wynika z tego, że system zarządzania jakością leku jest zwykle rozumiany jako zespół środków organizacyjnych zapewniających konsumentowi świadczenie wysokiej jakości opieki medycznej, co stanowi połączenie jakości samych leków i jakości leku farmaceutycznego. działalność organizacji aptekarskiej. Obecna sytuacja w zakresie zarządzania jakością wymaga opracowania praktycznych podejść i zasad zarządzania, aby rozwiązać problem zapewnienia dostępności leków wysokiej jakości dla ludności w każdej organizacji aptecznej.
4. Stworzenie systemu zarządzania jakością
leki w aptece
Zarządzenie Ministra Zdrowia Federacji Rosyjskiej nr 80 z dnia 4 marca 2003 r. „W sprawie zatwierdzenia normy branżowej „Zasady wydawania (sprzedaży) leków w aptekach. Przepisy podstawowe”. Zawiera sekcję IX Zapewnienie jakości produktów leczniczych (leków) w organizacjach aptecznych.
Organizacje farmaceutyczne lub indywidualni przedsiębiorcy muszą stworzyć system zapewnienia jakości, obejmujący:
Pomieszczenia i wyposażenie odpowiadające zakresowi działalności placówki aptecznej i umożliwiające zapewnienie przestrzegania warunków przechowywania i wytwarzania leków;
Dokumentacja pozwalająca na identyfikację pochodzenia, ilości i jakości przyjmowanych leków oraz prowadzenie ewidencji przechowywanych i sprzedawanych leków;
Kontrola przychodząca osób wchodzących do organizacji apteki lub przedsiębiorca indywidualny PO POŁUDNIU;
Personel posiadający wymagane kwalifikacje;
System ciągłego szkolenia personelu;
Opisy stanowisk pracy;
Zbiór materiałów regulacyjnych i referencyjnych, które powinny być dostarczone do wszystkich placówek aptecznych danej organizacji aptecznej.
Organizacja apteki musi posiadać system zarządzania jakością organizacji apteki.
Każda organizacja apteki musi posiadać wewnętrzny regulamin pracy zatwierdzony przez kierownika organizacji, z informacją, że pracownicy go przeczytali. Regulamin podlega corocznej weryfikacji i ponownemu zapoznawaniu się z nim przez personel apteki.
Organizacje apteczne muszą regularnie przeprowadzać audyty wewnętrzne pod kątem zgodności z wymogami GOST. Podczas przeprowadzania kontroli należy zwrócić uwagę na dostępność w organizacji apteki odpowiednich dokumentów dotyczących zajmowanego lokalu, opisów stanowisk pracy pracowników, standardów i innych niezbędnych dokumentów.
Kontrole mogą przeprowadzać zarówno pracownicy organizacji aptekarskiej, niezależni od osób bezpośrednio wykonujących kontrolowaną działalność, jak i niezależni eksperci. Częstotliwość kontroli ustala sama apteka. Wyniki kontroli są rejestrowane i podawane do wiadomości personelu odpowiedzialnego za kontrolowany obszar pracy oraz kierownictwa organizacji apteki. Kolejne audyty monitorują realizację zaleceń i ich skuteczność. Każdy pracownik organizacji aptecznej musi znać GOST, procedurę wykonywania powierzonych mu obowiązków, przepisy i standardy związane z działalnością organizacji. W organizacjach farmaceutycznych każdy pracownik musi mieć zatwierdzony w odpowiedni sposób opis stanowiska pracy.
Organizacje apteczne muszą posiadać system ciągłego doskonalenia zawodowego pracowników w zakresie obowiązującego ustawodawstwa, stosowania leków itp. Plan i tematyka zajęć zatwierdza kierownik organizacji apteki. Szef organizacji apteki wyznacza przedstawiciela ds. Jakości spośród kadry kierowniczej.
W tym zakresie nie ma wątpliwości co do konieczności ciągłego podnoszenia kwalifikacji zawodowych personelu farmaceutycznego. Jednym ze sposobów rozwiązania tego problemu jest zwiększenie efektywności systemu kształcenia podyplomowego farmaceutów.
Organizacja apteki zapewnia prowadzenie dokumentacji zgodnie z ustawowymi i regulacyjnymi aktami prawnymi Federacji Rosyjskiej.
Przede wszystkim zadaniem apteki jest zapewnienie zachowanych cech towarów otrzymywanych przez organizację apteki. Są to dwie grupy: walory użytkowe – efektywność i bezpieczeństwo, fizyczne i fizykochemiczne, wymagające przestrzegania zasad postępowania z nimi. W ramach systemu zarządzania jakością organizacji apteki każda apteka musi zorganizować:
1. Kontrola akceptacji. Ma to na celu zapobieganie przyjmowaniu i sprzedaży przez sieć aptek produktów podrobionych, odrzuconych i niespełniających norm. Reguluje to norma branżowa OST 91500.05.0007.-2003 „Zasady wydawania (sprzedaży) leków w aptekach”. Strefy (pomieszczenia) przyjmowania i wydawania leków muszą być oddzielone od obszaru przechowywania i muszą zapewniać właściwą (niezawodną) ochronę przyjmowanych leków przed niekorzystnymi warunkami pogodowymi podczas operacji załadunku (rozładunku). Powstałe produkty podlegają przychodzącej kontroli jakości. Wyniki kontroli przychodzącej należy rejestrować zgodnie z wewnętrznymi procedurami ustalonymi w placówce aptecznej. Podczas rozładunku produkty są sprawdzane pod kątem zgodności z zamówieniem oraz braku uszkodzeń opakowań lub pojemników. Leki i inne towary dopuszczone do sprzedaży w aptekach, posiadające upływający termin ważności, niespełniające wymagań i norm jakościowych oraz nieposiadające dokumentów potwierdzających ich jakość, nie podlegają przyjęciu. Protokół sporządza się dla produktów leczniczych (produktów leczniczych) w opakowaniach uszkodzonych, które nie posiadają atestów i/lub niezbędnej dokumentacji towarzyszącej, które zostały odrzucone przy przyjęciu lub wydane pacjentowi, które są niezgodne z zamówieniem lub które posiadają wygasły; muszą być odpowiednio oznakowane i umieszczone w wyznaczonym miejscu, oddzielonym od innych produktów leczniczych do czasu ich zidentyfikowania, zwrócenia dostawcy lub usunięcia w razie potrzeby. Trujący i silne substancje, środki odurzające, substancje psychotropowe, leki termolabilne należy natychmiast umieścić w miejscach przechowywania zgodnie z wymogami niniejszej OCTa.
Ilość przyjmowanych leków wymagających specjalnych warunków przechowywania musi odpowiadać dostępnej pojemności specjalistycznego sprzętu. Przyjęte leki i inne towary dopuszczone do wydania z aptek odbierane są w terminie wyznaczonym na przyjęcie towaru według liczby jednostek produktu i kompletności w przewidziany sposób. 6. Do każdej dostawy towaru należy dołączyć dokumenty pozwalające na ustalenie daty wysyłki, nazwy produktu leczniczego (w tym postaci dawkowania i dawkowania), numeru serii i partii, ilości dostarczonego towaru, ceny wydanego produktu leczniczego , nazwę i adres dostawcy i odbiorcy oraz dokumenty potwierdzające jakość produktów leczniczych. Dokumentami potwierdzającymi jakość leków jest deklaracja zgodności lub certyfikat zgodności.Ważnym wyznacznikiem jest to, że apteka lub sieć aptek współpracuje z rzetelną hurtownią, znanymi firmami ponadnarodowymi, które posiadają własną „usługę bezpieczeństwa leków” traktowaną bardzo poważnie.
Kontrola przyjęcia wraz ze sprawdzeniem poprawności dokumentów obejmuje sprawdzenie leków według wskaźników „Opis”, „Opakowanie”, „Oznakowanie”, które określają wymagania rozporządzenia Ministra Zdrowia Federacji Rosyjskiej z lipca 16, 1997. Nr 214 „W sprawie kontroli jakości leków wytwarzanych w organizacjach farmaceutycznych (aptekach)”. Kontrola na podstawie wskaźnika „Opis” obejmuje sprawdzenie wyglądu, koloru i zapachu. Niespójność koloru, obecność obcego zapachu, osadu, płatków, wtrąceń mechanicznych, zamarzania, rozwarstwiania są podstawą do odrzucenia. W przypadku wątpliwości co do jakości leków próbki przesyłane są do terytorialnego centrum kontroli jakości leków. Leki takie z oznaczeniem: „Odrzucone podczas kontroli przyjęcia” przechowywane są w aptece odizolowane od innych leków. Kontrola według wskaźnika „Opakowanie” obejmuje sprawdzenie integralności opakowania, obecności opakowania wtórnego oraz zgodności opakowania z właściwościami fizycznymi i chemicznymi leków.
2. Lokal i wyposażenie. Podstawowe wymagania dotyczące organizacji przechowywania leków i wyrobów medycznych w aptekach określa Instrukcja organizacji przechowywania różnych grup leków i artykułów medycznych w aptekach. Leki wymagające specjalnych warunków przechowywania należy natychmiast zidentyfikować i przechowywać w odpowiednich warunkach pomieszczenia magazynowe (powierzchnie) zgodnie z wymogami obowiązującego prawodawstwa. Powierzchnia magazynu aptecznego musi być na tyle obszerna, aby zapewnić uporządkowane przechowywanie różnych kategorii materiałów i produktów. Czyste i chronione. Leki w magazynach przemysłowych należy przechowywać na stojakach, paletach, półkach, szafach, chłodniach i innym specjalistycznym sprzęcie zapewniającym warunki przechowywania leków zgodne z obowiązującymi wymaganiami . Jeżeli w bazie aptecznej (magazynu) znajdują się leki immunobiologiczne, całkowita objętość urządzeń chłodniczych musi zapewniać, zgodnie z obowiązującymi wymaganiami, przechowywanie całej ilości tych leków znajdującej się w bazie (magazynu). Podczas przechowywania leków licencjobiorca ma obowiązek zapobiec ich uszkodzeniu (rozlanie, rozsypanie, stłuczenie), zanieczyszczeniu mikroorganizmami oraz zanieczyszczeniu krzyżowemu. Przechowywanie leków wymaga specjalnych warunków temperaturowych, kontrolowanych za pomocą urządzeń do ciągłego monitorowania temperatury lub pojemników termicznych.
3. Personel. W odniesieniu do zasobów obowiązuje trzecia zasada zarządzania – zaangażowanie pracowników. Podstawą organizacji są pracownicy wszystkich szczebli. Ich pełne zaangażowanie pozwala organizacji wykorzystać ich możliwości. Z jednej strony decyzja kierownictwa, że system zarządzania powinien funkcjonować, a z drugiej dopiero wtedy, gdy cały personel zda sobie sprawę, że system zarządzania to nie jest zwykły zbiór dodatkowych kartek papieru, który będzie stał na półce. To musi być skuteczna struktura i będzie działać tylko wtedy, gdy wszyscy zrozumieją, na czym się opiera i dlaczego się to robi. W każdej aptece, w takiej czy innej formie, stworzono system zarządzania jakością, który funkcjonuje z powodzeniem – dla niektórych wynosi on 10%, dla innych 90%.
4. Dokumentacja Czynności mające wpływ na jakość towaru muszą być opisane w pisemnych procedurach. System zarządzania jakością ma na celu usystematyzowanie procesów i sprawdzenie, czy wszystkie z nich są wyposażone w niezbędne zasoby i dokumenty. Ważne jest, aby wiedzieć, czy wszystkie procesy mają udokumentowane procedury i zasady realizacji. Aby podejmować decyzje zarządcze w oparciu o dowody, potrzebny jest proces analizy i doskonalenia – to siódma zasada zarządzania normami ISO. Skuteczne decyzje opierają się na analizie danych i informacji.
7. Zwroty. Niedozwolona jest obecność w obrocie leków niskiej jakości lub sfałszowanych, z wyłączeniem tych, których data ważności minęła. Po stwierdzeniu faktu obecności leków niskiej jakości, sfałszowanych i podobnych, przedsiębiorca musi sporządzić odpowiednią ustawę i podjąć działania mające na celu wykluczenie ich z obrotu. Wykluczenie takich leków z obrotu następuje poprzez recykling i zniszczenie zgodnie z Regulaminem utylizacji leków. Opracowano procedurę pracy z pismami Roszdravnador dotyczącymi odrzuconych i sfałszowanych produktów dla specjalistów Centrum zgodnie z wymogami i zgodnie z formularzami określonymi w piśmie Federalnej Służby Nadzoru Opieki Zdrowotnej i Rozwoju Społecznego z dnia 28 września 2004 r. Nr 4082/04.
5. Optymalizacja systemu zarządzania jakością działalności farmaceutycznej w aptece
W wyniku przestudiowania literatury dotyczącej zarządzania jakością farmaceutyczną można zaproponować optymalizację działań organizacji aptecznych poprzez wprowadzenie następujących zasad:
Jakość zarządzania jest pojęciem wieloaspektowym, obejmuje wiele elementów, takich jak przejrzystość i sterowalność procesów, jakość informacji, możliwość szybkiego monitorowania bieżących działań i wiele innych. Jednocześnie różne dokumenty są praktycznie jedynymi narzędziami zarządzania. Oczywistym sposobem na zmianę jakości zarządzania przedsiębiorstwem jest zatem zwiększenie efektywności pracy z dokumentami.
Zarządzanie jakością w aptece opiera się na następujących zasadach:
· Wystarczający asortyment i ilość leków w przystępnych cenach
Zadaniem apteki jest nic innego jak zaopatrzenie ludności w leki i produkty farmaceutyczne we właściwym miejscu i czasie dogodnym dla zwiedzających, dla których ustalane są potrzeby i dostawca, sporządzany jest wniosek, dokonywany jest zakup, i bada się dawkowanie.
· Dostępność społeczna
Prowadzenie badań asortymentu w granicach synonimów i analogów. W aptece występuje więcej niż jedna nazwa handlowa jednej substancji czynnej. Nazwy handlowe różnią się czasami o 100–700%, w zależności od producenta. Apteka dokonuje zakupów różnych nazw handlowych na różnych poziomach, aby zapewnić dostępność społeczną różnym grupom społecznym odwiedzających. W jednej grupie farmakoterapeutycznej można przyjmować leki drogie, średnio i tanie.
- Wsparcie informacyjne i doradcze
Pracownicy apteki muszą przewidywać oczekiwania konsumentów i dbać o to, aby produkt spełniał te oczekiwania. Nie zawsze jest to możliwe. Na przykład konsument chce uzyskać poradę od farmaceuty przed zakupem leku. Farmaceuta nie jest jednak lekarzem i w naszym kraju nie ponosi ustawowej odpowiedzialności za zdrowie pacjenta. Jednak nie otrzymując tego, czego oczekiwał, konsument pozostaje niezadowolony.
- Wdrażanie systemów komputerowych w aptekach i wykorzystanie kodów kreskowych do kontroli jakości leków w aptekach
System automatyzacji przedsiębiorstwa aptecznego różni się od systemów automatyzacji przedsiębiorstw detalicznych. Apteki mają wiele własnych cech, głównie związanych z cenami, co w Rosji zawsze było skomplikowanym i zagmatwanym procesem. Ceny w aptece są ustalane zgodnie z określonymi dokumentami prawnymi i są ściśle regulowane, istnieje lista leków, które nie są opodatkowane. Cena detaliczna takich leków jest ustalana inaczej. Wcześniej dla pracowników aptek proces odbioru towaru i ustalania cen był pracochłonny i czasochłonny. Dlatego automatyzacja jest tutaj po prostu niemożliwa.
Systemy automatyzacji umożliwiają pracownikom aptek przeglądanie danych o tym, co jest w magazynie, jakich leków nie ma w magazynie, a co należy dodatkowo kupić. Proces szybkiego podglądu sald rzeczywistych jest jednym z najważniejszych przy wyborze systemu automatyki.
W każdej zwykłej aptece, w której znajduje się prosta kasa fiskalna, dokonując zakupu, pieniądze, które wpłacamy do kasy, nie są w żaden sposób bezpośrednio powiązane z produktem, który otrzymujemy.
I tutaj od razu pojawia się kilka problemów:
Po pierwsze, w aptece brakuje pełnej i szczegółowej księgowości przepływu towarów i środków finansowych. Nie da się np. w każdej chwili powiedzieć, ile danego produktu zostało sprzedane, ile pozostało na sali sprzedaży czy w magazynie, nie da się automatycznie zabronić magazynowania towaru, którego już się skończyło itp. ;
Po drugie, trudno uniknąć błędów, jakie może popełnić kasjer;
Po trzecie, brak szczegółowej księgowości nie pozwala na prowadzenie statystyk i szczegółowej analizy dynamiki sprzedaży, co uniemożliwia bardziej elastyczne reagowanie na zmiany popytu.
6. Analiza i sposoby doskonalenia systemu zarządzania jakością leków w aptece firmy MAIR LLC
MAIR LLC działa na rynku farmaceutycznym od ponad 15 lat na Terytorium Primorskim. Jej sieć aptek obejmuje 5 placówek detalicznych i cieszy się ogromną popularnością – karty stałego klienta posiada kilka tysięcy mieszkańców Władywostoku. Zajmuje drugie piętro w 2-piętrowym budynku. Lokal apteki jest nowy, działa od maja 2010 roku, spełnia wszystkie wymogi NDT i norm sanitarnych, czynny jest w godzinach 9:00 - 20:00 siedem dni w tygodniu. Znajdują się tam tabliczki wskazujące nazwę apteki i godziny jej otwarcia. Zlokalizowany jest w dogodnej dla zwiedzających lokalizacji, w pobliżu przystanku autobusowego.
Mair za swoją główną misję uważa nie tyle sprzedaż leków, sprzedaż farmaceutyków i leków, wyrobów medycznych, ale raczej świadczenie usług farmaceutycznych na wysokim poziomie, dlatego firma stara się skupić na kliencie, gwarantować jakość leków I służyć kupującemu najlepiej jak to możliwe. Wszystko to, w połączeniu ze zrozumiałą chęcią usprawnienia swojej pracy, skłoniło kierownictwo do zastanowienia się nad wprowadzeniem systemu zarządzania jakością.
Apteka, pracując w systemie zarządzania jakością krócej niż rok, może wyciągnąć pewne wnioski. Obiektywne wskaźniki potwierdzają, że wprowadzenie systemu zarządzania jakością przyczyniło się do optymalizacji kapitału obrotowego: wzrósł wolumen sprzedaży w aptekach sieci, zmniejszyła się liczba towarów niskorentownych i niepłynnych oraz produktów przeterminowanych. Zwiększyła się liczba stałych klientów. Analiza ich potrzeb, życzeń i propozycji pozwoliła praktycznie pozbyć się usterek. Dodatkowo, dzięki skupieniu personelu na pracy z klientem, nie tylko znacząco wzrosła liczba zakupów online, ale zoptymalizowano ich średni koszt. Specjaliści ds. zarządzania jakością zauważają obecnie, że głównym i najbardziej problematycznym ogniwem każdej struktury zarządzania są ludzie. W naszym przypadku - specjaliści farmaceuci. Ci, którzy mają bezpośredni kontakt z klientami, gośćmi, konsumentami. W celu wdrożenia systemu zarządzania jakością w aptece dokonano zmian w strukturze organizacyjnej i relacjach wewnątrz zespołu. Efektywny system szkolenia personelu oraz stały monitoring szkoleń poprawiły jakość pracy personelu.
1. W wyniku analizy danych z literatury zagranicznej i krajowej ustalono, że wiele uwagi poświęca się zagadnieniom systemu zarządzania jakością leków w placówkach farmakologicznych zarówno w Rosji, jak i za granicą. Studiując podstawowe pojęcia z zakresu budowy modeli i funkcjonowania systemów zarządzania jakością, wyraźnym przywództwem są podejścia oparte na koncepcji kompleksowego zarządzania jakością (TQM) i normach serii ISO 9000, które podają szereg ogólnych zasad: klient koncentracja, przywództwo w zarządzaniu, podejście procesowe, podejście systemowe, ciągłe doskonalenie, wzajemnie korzystne relacje z dostawcami itp.
2. System zarządzania jakością w zakresie obrotu lekami w Rosji określa ustawa federalna nr 86 „O lekach” Zarządzanie jakością w organizacjach farmaceutycznych opiera się na zasadach TQM i standardach serii ISO 9000 oraz. standardy branżowe: OST91500.05.0005-2002 „Zasady hurtowego obrotu lekami. Przepisy podstawowe”, zatwierdzone zarządzeniem Ministra Zdrowia Federacji Rosyjskiej z dnia 15 marca 2002 r. nr 80; OST 91500.05.0007-2003.
3. Zgodnie z praktyką międzynarodową apteka ponosi pełną odpowiedzialność za jakość produktów nabywanych od dostawców, jedynie obowiązkowe wymagania dotyczące produktów są określone przez prawo, a wszystkie pozostałe warunki są określone w umowie pomiędzy uczestnikami rynku.
4. System zarządzania jakością w zakresie obrotu lekami musi mieć charakter rzetelny, prewencyjny, zapobiegający świadczeniu konsumentowi usług farmaceutycznych poniżej standardów, a także spersonalizowany, tj. mają za to konkretne osoby odpowiedzialne.
5. Rozważa się pewne zasady pozwalające na optymalizację systemu zarządzania jakością w zakresie obrotu lekami w aptekach Studiując literaturę dotyczącą zarządzania jakością produktów farmaceutycznych można zaproponować optymalizację działań organizacji aptecznych poprzez wprowadzenie poniższych zasad.
BIBLIOGRAFIA
1. Zarządzenie Ministra Zdrowia Federacji Rosyjskiej z dnia 4 marca 2003 r. Nr 80 „W sprawie zatwierdzenia normy branżowej „Zasady wydawania (sprzedaży) leków w aptekach. Przepisy podstawowe”.
2. Skulkova R.S., Yagudina R.I., Parkhomenko D.V. Stworzenie systemu zarządzania jakością dla organizacji farmaceutycznych. Nowa apteka. Przepisy prawne. 2005.-N 4.-P.32-37.
3. Komissinskaya I.G. Nowoczesna koncepcja zarządzania jakością organizacji aptecznej // Apteki w Moskwie. – 2007 r. – nr 11.
4. Alferova, T.V. Zarządzanie produkcją w przedsiębiorstwach przemysłu farmaceutycznego / T.V. Alferova, E.A. Tretyakova, A.V. Builin. – Jekaterynburg: Wydawnictwo Instytutu Ekonomii Oddziału Uralskiego Rosyjskiej Akademii Nauk, 2008. – 214 s.
5. Moskvin V.A. Ewolucja w dziedzinie zarządzania jakością / V.A. Moskvin // Inwestycje w Rosji 2004. nr 5.- s. 27-28.
6. Łagutkina T.P. Zasady zarządzania jakością w działalności organizacji farmaceutycznej // Biuletyn Uniwersytetu Przyjaźni Narodów Rosyjskich. 2008.-N 4.-P.36-39.
7. Poleski V.A. Ewolucja modeli systemów jakości: praktyka międzynarodowa / V.A. Poleski, SA Martynchik, V.G. Zaporożenko, V.Z. Kucherenko // Ekonomika opieki zdrowotnej. - 2005. - nr 8. - s. 25-36.
8. Ustawa federalna „O lekach” nr 86-FZ z dnia 22 czerwca 1998 r.
9. Drugova Z.K., Biteryakova A.M. System kontroli wewnętrznej i jakość zarządzania // Rosyjskie apteki. – №2. – 2007.
10. Kononova S.V. System zapewnienia jakości usług farmaceutycznych w regionalnym kompleksie farmaceutycznym: Monografia. -Niżny Nowogród: Wydawnictwo VGIPA, 2003.
11. Warunki przechowywania leków. – M.: Medycyna, 2006. – 184 s.
12. Kulaev V.A., Egorov V.A., Gladunova E.P., Ezhkov V.N. Zintegrowany system zarządzania jakością w opiece farmaceutycznej // Apteka, 2011, nr 3, s. 30-33
I. Kontrola akceptacji
A. Prowadzona jest kontrola przyjęcia, aby zapobiec przedostawaniu się do apteki leków niskiej jakości.
B. Kontrola przyjęcia polega na sprawdzeniu przychodzących leków pod kątem zgodności z wymaganiami dla następujących wskaźników: „Opis”; "Pakiet"; "Cechowanie"; przy sprawdzaniu prawidłowości wykonania dokumentów płatniczych (faktur), a także dostępności certyfikatów zgodności producenta i innych dokumentów potwierdzających jakość leków zgodnie z obowiązującymi przepisami dokumenty regulacyjne.
I. Kontrola na podstawie wskaźnika „Opis” obejmuje sprawdzenie wyglądu, koloru i zapachu. W przypadku wątpliwości co do jakości leków próbki przesyłane są do terytorialnego laboratorium kontroli i analiz. Leki takie z oznaczeniem: „Odrzucone w trakcie kontroli przyjęcia” przechowywane są w aptece odizolowane od pozostałych leków.
II. Sprawdzając wskaźnik „Opakowanie”, szczególną uwagę zwraca się na jego integralność i zgodność z właściwościami fizykochemicznymi leków.
iii. Monitorując wskaźnik „Oznakowanie”, zwraca się uwagę na zgodność projektu leków z aktualnymi wymaganiami.
IV. Specjalna uwaga Należy zwrócić uwagę na zgodność oznakowania opakowań podstawowych, wtórnych i grupowych, obecność w opakowaniu ulotki w języku rosyjskim (lub osobno w opakowaniu na całą ilość gotowego produktu leczniczego).
w. Etykiety na opakowaniach substancji leczniczych przeznaczonych do sporządzania roztworów do wstrzykiwań i infuzji muszą zawierać informację „Nadaje się do wstrzykiwań”. Opakowania z lekami trującymi i odurzającymi muszą być zaprojektowane zgodnie z wymogami ustawodawstwa Federacji Rosyjskiej i dokumentami regulacyjnymi.
VI. Surowce roślin leczniczych otrzymywane od populacji sprawdzane są według wskaźnika „ Znaki zewnętrzne» zgodnie z wymogami Farmakopei Państwowej lub aktualnego dokumentu regulacyjnego, po czym przesyłany jest do analizy do terytorialnego laboratorium kontrolno-analitycznego.
II. Środki zapobiegawcze
1. Środki zapobiegawcze polegają na spełnieniu następujących wymagań:
A. Przestrzeganie norm i przepisów sanitarnych; reżim przeciwepidemiczny, a także warunki aseptycznej produkcji leków zgodnie z obowiązującymi dokumentami regulacyjnymi.
B. Przestrzeganie zasad pozyskiwania, gromadzenia i przechowywania wody oczyszczonej i wody do iniekcji; terminowa obróbka sanitarna rurociągu; kontrola nad terminowym pobraniem roztworów sterylnych, wody oczyszczonej, wody do iniekcji do badania sterylności zgodnie z aktualnymi wymaganiami.
2. Pojemniki na wodę oczyszczoną i wodę do iniekcji muszą być opatrzone wyraźnym napisem: „Woda oczyszczona”, „Woda do iniekcji”. Do poboru wody dołączana jest przywieszka zawierająca datę otrzymania, numer analizy i podpis osoby sprawdzającej. Jeżeli jednocześnie używanych jest kilka kolekcji, należy je ponumerować.
A. Zapewnianie sprawności i dokładności przyrządów, aparatury i urządzeń wagowych oraz regularne ich sprawdzanie.
B. Dokładny przegląd recept otrzymywanych przez aptekę i wymagań organizacji medycznych w celu sprawdzenia prawidłowości ich przepisywania; zgodność substancji wchodzących w skład produktów leczniczych; zgodność przepisanych dawek z wiekiem pacjenta i dostępność instrukcji stosowania leków.
C. Zgodność technologii leków (w tym homeopatycznych) zgodnie z wymogami aktualnej Farmakopei Państwowej, dokumentami regulacyjnymi i wytycznymi.
D. Zapewnienie warunków przechowywania leków w aptece zgodnie z ich przepisami fizyczne i chemiczne właściwości oraz wymagania Farmakopei Państwowej i aktualnych dokumentów regulacyjnych.
I. W pomieszczeniach magazynowych na wszystkich pojemnikach z lekami należy podać: numer serii producenta, numer analizy laboratorium kontrolno-analitycznego (ośrodka kontroli jakości leku), datę ważności, datę napełnienia oraz podpis osoby napełniającej pojemnik . Kostki zawierające produkty lecznicze zawierające glikozydy nasercowe muszą wskazywać liczbę jednostek działania w jednym gramie leczniczego materiału roślinnego lub w jednym mililitrze produktu leczniczego.
II. W pokojach asystenta na wszystkich pojemnikach z substancjami leczniczymi należy umieścić: datę napełnienia, podpis osoby napełniającej pojemnik oraz osoby sprawdzającej autentyczność substancji leczniczej. Najwyższe dawki jednorazowe i dzienne należy wskazać na prętach z toksycznymi i silnymi substancjami leczniczymi, a na prętach z substancjami leczniczymi przeznaczonymi do wytwarzania sterylnych postaci dawkowania należy umieścić ostrzeżenie: „W przypadku sterylnych postaci dawkowania”.
iii. Sztangi z roztworami, nalewkami i półproduktami płynnymi należy zaopatrzyć w zwykłe kroplomierze lub pipety. Liczbę kropli w określonej objętości należy określić poprzez zważenie i wskazać na pręcie.
IV. Napełnianie pręta, biurety w biurecie, pręta ze zwykłym kroplomierzem lub pipety należy wykonywać dopiero po pełne wykorzystanie produktu leczniczego i odpowiedniego leczenia pręcika.
mi. Nazewnictwo koncentratów, półproduktów i zakupów wewnątrzaptekowych leków wytwarzanych w aptekach musi zostać zatwierdzone przez terytorialne laboratorium kontrolno-analityczne i podane do wiadomości wszystkich aptek na danym terytorium. Lista ta może obejmować wyłącznie recepty zawierające kompatybilne substancje lecznicze, dla których istnieją analityczne metody kontroli chemicznej*.
F. Kierownicy aptek muszą raz na kwartał monitorować przestrzeganie zasad przechowywania leków w działach organizacji medycznych przy aptece.
3. W działach organizacji medycznych nie jest dozwolona produkcja leków, pakowanie, przenoszenie z jednego pojemnika (opakowania) do drugiego i wymiana etykiet. Leki należy przechowywać na oddziałach wyłącznie w oryginalnych opakowaniach (fabrycznych, fabrycznych lub aptecznych).
4. Aby kontrolować datę ważności, na opakowaniu opakowania sprzedawanego przez aptekę działowi organizacji medycznej należy podać serię producenta.
5. Leki z aptek do organizacji medycznych powinny być wydawane wyłącznie upoważnionemu personelowi medycznemu.
III. Kontrola pisemna
1. Przy wytwarzaniu postaci dawkowania zgodnie z przepisami i wymaganiami organizacji medycznych wypełniane są pisemne paszporty kontrolne. W paszporcie należy podać: datę produkcji, numer recepty (numer organizacji medycznej, nazwę oddziału), nazwę przyjmowanych substancji leczniczych i ich ilości, liczbę dawek, podpisy osoby, która wyprodukowała, spakowała i sprawdziła dawkowanie formularz. W przypadku produkcji postaci dawkowania praktykant składa podpis osoby odpowiedzialnej za praktykę produkcyjną.
2. Wszystkie obliczenia muszą zostać wykonane przed wyprodukowaniem i zarejestrowaniem postaci dawkowania tylna strona paszporty. Paszport jest wypełniany natychmiast po wyprodukowaniu postaci dawkowania, z pamięci, w dniu łacina zgodnie z kolejnością operacji technologicznych. Podczas wypełniania paszportu dla homeopaty formy dawkowania Wskazane są homeopatyczne nazwy kolejno przyjmowanych leków.
3. W przypadku stosowania półproduktów i koncentratów w paszporcie wskazany jest ich skład, stężenie, objętość lub pobrana masa. Przygotowując proszki, czopki i pigułki, podaje się całkowitą masę, ilość i wagę poszczególnych dawek. Całkowita masa tabletek lub czopków, stężenie i objętość (lub masa) substancji izotonicznych i stabilizujących dodawanych do kropli do oczu, roztworów do wstrzykiwań i naparów muszą być podawane nie tylko w paszportach, ale także na receptach.
4. W paszporcie należy podać wzory obliczeniowe i współczynniki absorpcji wody stosowane w surowcach roślin leczniczych, współczynniki zwiększania objętości roztworów podczas rozpuszczania substancji leczniczych oraz współczynniki substytucji do produkcji czopków.
5. Posiadanie pisemnych paszportów kontroli jest konieczne również w przypadku, gdy formy dawkowania są wytwarzane i wydawane przez tę samą osobę. W takim przypadku paszport jest wypełniany podczas procesu wytwarzania postaci dawkowania.
6. Pisemne paszporty kontrolne przechowuje się w aptece przez okres dwóch miesięcy od daty wytworzenia produktu leczniczego.
7. Wyprodukowane leki, recepty i wypełnione paszporty poddawane są weryfikacji farmaceutowi pełniącemu funkcje kontrolne w zakresie wytwarzania i wydawania leków (zwanego dalej „farmaceutą-technologiem”). Kontrola polega na sprawdzeniu zgodności wpisów w paszporcie z pisemną kontrolą recepty w przepisie oraz poprawności dokonanych obliczeń. Jeżeli pełna chemiczna kontrola jakości produktu leczniczego została przeprowadzona przez farmaceutę-analityka, wówczas w paszporcie umieszcza się numer analizy i podpis farmaceuty-analityka.
8. Przy produkcji koncentratów, półproduktów, zaopatrzeniu aptecznym i konfekcjonowaniu leków wszelkich wpisów dokonuje się w księgach prac laboratoryjnych i konfekcjonowania.
IV. Kontrola ankiety
1. Kontrola ankietowa stosowana jest wybiórczo. Przeprowadza się ją po przygotowaniu przez farmaceutę nie więcej niż pięciu postaci dawkowania.
2. Dokonując kontroli ankietowej, farmaceuta-technolog podaje nazwę pierwszej substancji zawartej w postaci leku, a w postaciach dawki o składzie złożonym wskazuje także jej ilość, po czym farmaceuta podaje nazwę wszystkich przyjmowanych substancji leczniczych i ich ilości. Stosując półprodukty (koncentraty) farmaceuta podaje także ich skład i stężenie.
1. Wyjątkowo produkcja wód aromatycznych, przygotowywanie w aptece leków do użytku zewnętrznego zawierających smołę, ichtiol, siarkę, olej naftalanowy, kolodion, wodę ołowiową, a także leków homeopatycznych, których analizy nie można przeprowadzić w aptece odbywa się pod nadzorem farmaceuty zajmującego się kontrolą jakości leków.
V. Kontrola organoleptyczna
1. Kontrola organoleptyczna polega na sprawdzeniu postaci leku (w tym homeopatycznej) według następujących wskaźników: „Opis” (wygląd, kolor, zapach), jednorodność, brak widocznych wtrąceń mechanicznych (w płynnych postaciach leku). Postacie leku przeznaczone dla dzieci są selektywnie badane pod kątem smaku.
2. Jednorodność proszków, rozcierań homeopatycznych, maści, pigułek, czopków sprawdza się zgodnie z wymogami Farmakopei Państwowej i aktualnymi dokumentami regulacyjnymi. Kontrola przeprowadzana jest wyrywkowo u każdego farmaceuty w ciągu dnia roboczego, z uwzględnieniem różne rodzaje formy dawkowania.
3. Wyniki kontroli organoleptycznej postaci dawkowania odnotowuje się w dzienniku według załączonego formularza (załącznik nr 2 do niniejszej Instrukcji).
VI. Kontrola fizyczna
1. Kontrola fizyczna polega na sprawdzeniu całkowitej masy lub objętości postaci dawkowania, liczby i masy poszczególnych dawek (co najmniej trzech dawek) zawartych w tej postaci dawkowania.
2. Sprawdzone:
3. każda seria opakowań i preparatów aptecznych w ilości co najmniej trzech opakowań (w tym opakowania produktów przemysłowych i leków homeopatycznych);
4. postacie dawkowania produkowane według indywidualnych receptur (wymagań), selektywnie w ciągu dnia roboczego, z uwzględnieniem różnych rodzajów postaci dawkowania, jednak nie mniej niż 3% dziennej liczby postaci dawkowania;
5. każdą serię postaci dawkowania wymagających sterylizacji, po zapakowaniu przed ich sterylizacją w ilości co najmniej pięciu fiolek (butelek);
6. liczba granulek homeopatycznych w określonej masie próbki zgodnie z wymogami aktualnych dokumentów regulacyjnych.
7. Wyniki kontrola fizyczna rejestrowane są w dzienniku zgodnie z załączonym formularzem (załącznik nr 2 do niniejszej Instrukcji).
8. Podczas sprawdzania postaci dawkowania monitorowana jest również jakość zamknięcia.
VII. Kontrola chemiczna
1. Kontrola chemiczna polega na ocenie jakości wytwarzania produktu leczniczego według następujących wskaźników: „Autentyczność”, „Badania czystości i dopuszczalnych granic zanieczyszczeń” (analiza jakościowa) i „Określenie ilościowe” (analiza ilościowa) substancje lecznicze zawarte w jego składzie.
2. Analizie jakościowej podlegają:
3. Woda oczyszczona, woda do wstrzykiwań codziennie (z każdej butli oraz gdy woda jest dostarczana rurociągiem na każdym stanowisku pracy) na brak chlorków, siarczanów i soli wapnia. Woda przeznaczona do produkcji roztworów sterylnych, oprócz powyższych badań, musi zostać zbadana na obecność substancji redukujących, soli amonowych i dwutlenku węgla, zgodnie z wymaganiami aktualnej Farmakopei Państwowej. Co kwartał oczyszczoną wodę należy przesyłać do terytorialnego laboratorium kontrolnego i analitycznego w celu pełnej analizy chemicznej.
4. Wszelkie leki, koncentraty i półprodukty (w tym nalewki homeopatyczne, rozcierania, roztwory, rozcieńczenia) przywożone z magazynu do pokoju asystenta, a w razie wątpliwości - leki przychodzące do apteki z magazynu.
5. Koncentraty, półprodukty i leki płynne w biuretach oraz w pręcikach z pipetami w pomieszczeniu asysty podczas napełniania.
6. Leki produkcja przemysłowa pakowane w aptece oraz preparaty apteczne produkowane i pakowane w aptece (każda seria).*
7. . Analiza jakościowa przeprowadzana jest wybiórczo:
8. . Postacie dawkowania wyprodukowane według indywidualnych receptur i wymagań organizacji medycznych są dostępne dla każdego farmaceuty w ciągu dnia roboczego, jednak nie mniej niż 10% ogólnej liczby wyprodukowanych postaci dawkowania. Należy przetestować różne rodzaje postaci dawkowania. Szczególną uwagę zwraca się na postacie dawkowania: dla dzieci; stosowany w praktyce okulistycznej; zawierające substancje odurzające i toksyczne.
9. Seria -- określona ilość jednorodny produkt końcowy (lek) wytwarzany w jednym cyklu produkcyjnym w stałych warunkach.
10. Analizie jakościowej poddawane są selektywne rozcieńczenia homeopatyczne czwartego dziesiętnego rozcieńczenia zawierające substancje trujące i biologicznie silne. substancje czynne lub toksyczne i silne związki nieorganiczne i organiczne.
jedenaście.. Wyniki analizy jakościowej rejestruje się w dziennikach na załączonych formularzach (załączniki nr 2,3,4 do niniejszej Instrukcji).
12. Analizie jakościowej i ilościowej (pełna kontrola chemiczna) podlegają:
13. . Wszelkie roztwory do wstrzykiwań i naparów przed sterylizacją, łącznie z określeniem wartości pH, substancji izotonicznych i stabilizujących. Roztwory do wstrzykiwań i naparów po sterylizacji sprawdzane są pod kątem wartości pH, autentyczności i zawartości ilościowej Składniki aktywne. Stabilizatory w tych roztworach po sterylizacji są sprawdzane w przypadkach przewidzianych przez aktualne dokumenty regulacyjne, w tym wytyczne. Do kontroli po sterylizacji z każdej partii pobiera się jedną butelkę roztworu.
14. Sterylne roztwory do użytku zewnętrznego (roztwory okulistyczne do irygacji, roztwory do leczenia powierzchni oparzeniowych i otwarte rany do podawania dopochwowego itp.).
15. Krople i maści do oczu zawierające substancje odurzające i toksyczne. Analizując krople do oczu, przed sterylizacją określa się w nich zawartość substancji izotonicznych i stabilizujących.
16. Wszystkie postacie dawkowania dla noworodków*.
17. . Roztwory siarczanu atropiny i kwasu solnego (do użytku wewnętrznego), roztwory dichlorku rtęci i azotanu srebra.
18. . Wszystkie koncentraty, półprodukty, rozcierania, w tym płynne homeopatyczne rozcieńczenia nieorganicznych i organicznych substancji leczniczych oraz ich rozcierania do trzeciego miejsca po przecinku**.
19. . Wszystkie zakupy leków w aptece (każda seria).
20. Stabilizatory stosowane do produkcji roztworów do wstrzykiwań i roztwory buforowe stosowane do produkcji kropli do oczu.
21. Stężenie alkoholu etylowego po rozcieńczeniu w aptece iw razie potrzeby po otrzymaniu z magazynu.
22. Wyjątkowo wytwarzanie postaci dawkowania o złożonym składzie dla noworodków, które nie posiadają metod analizy jakościowej i ilościowej, odbywa się pod nadzorem farmaceuty-analityka lub farmaceuty-technologa.
23. Stężenie alkoholu etylowego w wodno-alkoholowych roztworach homeopatycznych, rozcieńczeniach i kroplach (każda seria).
24. Granulat homeopatyczny do rozdrabniania (każda seria) zgodnie z wymaganiami aktualnych dokumentów regulacyjnych.
25. Analizę jakościową i ilościową (pełna kontrola chemiczna) przeprowadza się selektywnie:
26. Dawki sporządzone w aptece według indywidualnych receptur lub wymagań organizacji medycznych sprawdza się w ilości co najmniej trzech postaci dawkowania przy pracy na jedną zmianę, z uwzględnieniem różnych rodzajów postaci dawkowania. Szczególną uwagę zwraca się na postacie dawkowania dla dzieci: stosowane w praktyce okulistycznej; zawierające substancje odurzające i toksyczne; rozwiązania do lewatyw leczniczych.
27. Wyniki całkowitej kontroli chemicznej odnotowuje się w dzienniku według załączonego formularza (załącznik nr 2 do niniejszej Instrukcji). Wszystkie przypadki niezadowalającej produkcji leków muszą być odnotowane w dzienniku.
