Система забезпечення якості у аптечних організаціях. Створення системи управління якістю лікарських засобів в аптеці
Повнотекстовий пошук:
Головна > Реферат >Медицина, здоров'я
лікарських засобівв аптеці
Наказ МОЗ РФ №80 від 04.03.2003 р. «Про затвердження Галузевого стандарту «Правила відпустки (реалізації) лікарських засобів у аптечних організаціях. Основні положення". Містить розділ IX Забезпечення якості лікарських препаратів(лікарських засобів) в аптечних організаціях.
В аптечних організаціях або в індивідуальних підприємців має бути створена система забезпечення якості, що включає:
приміщення та обладнання, що відповідають обсягу діяльності аптечного об'єкта та що дозволяє забезпечити дотримання умов зберігання та виготовлення ЛЗ;
документацію, що дозволяє ідентифікувати походження, кількість і якість вступників і вести облік ЛЗ, що зберігаються і реалізуються;
вхідний контроль вступників до аптечної організації або індивідуального підприємця ЛЗ;
персонал необхідної кваліфікації;
систему безперервного навчання персоналу;
фонд нормативних та довідкових матеріалів, якими мають бути забезпечені всі аптечні об'єкти цієї аптечної організації.
В аптечній організації має бути сформована система управління якістю аптечної організації.
Кожна аптечна організація повинна мати правила внутрішнього трудового розпорядку, затверджені керівником організації з відміткою про ознайомлення працівників. Перегляд правил та повторне ознайомлення з ними працівників аптечної організації провадиться щорічно.
Аптечною організацією повинні регулярно проводитись внутрішні перевірки на відповідність вимогам ГОСТу. При проведенні перевірок слід звертати увагу на наявність в аптечній організації відповідних документів на приміщення, посадових інструкцій співробітників, стандартів, інших необхідних документів.
Перевірки можуть проводитися як працівниками аптечної організації незалежними від осіб, які безпосередньо здійснюють діяльність, що перевіряється, так і незалежними експертами. Частота перевірок визначається самою аптечною організацією. Результати перевірок протоколюються і доводяться до відома персоналу, відповідального за ділянку роботи, що перевіряється, і керівництва аптечної організації. При наступних перевірках контролюється виконання рекомендацій та його ефективність. Кожен співробітник аптечної організації може бути ознайомлений з ГОСТом, порядком виконання закріплених його обов'язків, нормативними правовими актами і стандартами, які стосуються діяльності організації. В аптечних організаціях кожного співробітника мають бути посадові інструкції, затверджені у порядку.
В аптечних організаціях має бути передбачена система постійного підвищення професійної освіти працівників з питань чинного законодавства, застосування лікарських засобів та ін. План та теми занять затверджуються керівником аптечної організації. Керівник аптечної організації призначає із керівного персоналу уповноваженого за якістю.
У цьому немає сумнівів необхідність постійного вдосконалення професійних навичок фармацевтичних кадрів. Одним із шляхів вирішення цього завдання є підвищення ефективності системи післядипломної підготовки провізорів.
Аптечна організація забезпечує ведення документації відповідно до законодавчих та нормативних правових актів. Російської Федерації.
Насамперед завдання аптеки – надання збережених характеристик товарів, що надійшли в аптечну організацію. Це дві групи: функціональні якості – ефективність та безпека, фізичні та фізико-хімічні, що вимагають дотримання правил поводження з ними. В рамках системи управління якістю аптечної організації в кожній аптеці повинен бути організований:
1. Приймальний контроль. Він проводиться з метою запобігання надходженню та реалізації через аптечну мережу фальсифікованої, забракованої та недоброякісної продукції. Він регламентований Галузевим стандартом ОСТ 91500.05.0007.-2003 "Правила відпустки (реалізації) лікарських засобів в аптечних організаціях". Зони (приміщення) приймання лікарських засобів та відпустки повинні бути відокремлені від зони зберігання та повинні забезпечувати належний (надійний) захист отриманих лікарських засобів від негоди під час вантажно-розвантажувальних робіт. Отримана продукція підлягає контролю якості. Результати вхідного контролю мають бути зареєстровані відповідно до встановленого в аптечному закладі внутрішнім порядком. Під час розвантаження продукціїпроводять перевірку на її відповідність замовлення та відсутність пошкоджень упаковок чи тари. Не підлягають прийманню лікарські препарати та інші товари, дозволені до реалізації з аптечних організацій, з термінами придатності, що закінчилися, не відповідають вимогам до якості, стандартам і без документів, що засвідчують їх якість. На лікарські препарати (лікарські засоби) у пошкодженій упаковці, що не мають сертифікатів та/або необхідної супровідної документації, забраковані при прийманні або відпустці хворому, що не відповідають замовленню або з терміном придатності, що закінчився, складається акт; вони повинні бути відповідним чином промарковані та поміщені у спеціально виділену зону окремо від інших лікарських засобів до їх ідентифікації, повернення постачальнику або знищення в установленому порядку. Отруйні та сильнодіючі речовини, наркотичні засоби, психотропні речовини, термолабільні лікарські препарати необхідно негайно розміщувати у місцях зберігання відповідно до вимог даного OCTa.
Кількість лікарських препаратів, що вимагаються особливих умов зберігання, повинна відповідати наявній ємності спеціального обладнання. Прийняті лікарські препарати та інші товари, дозволені до відпустки з аптечних організацій, приходять протягом термінів, відведених по прийманню товару за кількістю товарних одиниць та комплектності в установленому порядку. 6. Усі поставки товару повинні супроводжуватися документами, що дозволяють встановити дату відвантаження, найменування лікарського препарату (включаючи лікарську форму та дозування), номер серії та партії, кількість поставленого товару, ціну відпущеного лікарського препарату, назву та адресу постачальника та одержувача, а також документами, що підтверджують якість лікарських препаратів. Документами, що підтверджують якість лікарських засобів, є декларація про відповідність або сертифікат відповідності Важливим показникомє і те, що аптека або мережа аптекпрацюють із надійною оптовою ланкою, відомими транснаціональними компаніями, у яких своя «служба безпеки ліків» поставлена дуже серйозно.
Приймальний контроль, поряд з перевіркою правильності оформлення документів, включає перевірку лікарських засобів за показниками «Опис», «Упаковка», «Маркування», що визначено вимогами наказу МОЗ РФ від 16.07.97. № 214 "Про контроль якості лікарських засобів, що виготовляються в аптечних організаціях (аптеках)". Контроль за показником "Опис" включає перевірку зовнішнього вигляду, кольору, запаху. Невідповідність за кольором, наявності стороннього запаху, осаду, пластівців, механічних включень, замерзання, розшарування є підставами для забраковування. У разі сумніву як лікарські засоби зразки направляються до територіального центру контролю якості лікарських засобів. Такі лікарські засоби з позначенням: «Зібраковано при приймальному контролі» зберігаються в аптеці ізольовано від інших лікарських засобів. Контроль за показником «Упаковка» включає перевірку цілісності упаковки, наявність вторинної упаковки, відповідність упаковки фізико-хімічним властивостям лікарських засобів.
2. Приміщення та обладнання.Основні вимоги щодо організації зберігання лікарських засобів та виробів медичного призначенняв аптечних установах встановлені Інструкцією з організації зберігання в аптечних установах різних груплікарських засобів та предметів медичного призначення. Лікарські засоби, які потребують особливих умов зберігання, повинні бути негайно ідентифіковані та розміщені у відповідних приміщеннях (зонах) зберіганнязгідно з вимогами чинного законодавства. Приміщення для зберігання в аптеці має бути досить просторим, щоб забезпечити впорядковане зберігання різних категорій матеріалів та продуктів. Чистим та захищеним. Лікарські засоби у виробничих складських приміщенняхповинні зберігатися на стелажах, піддонах, підтоварниках, у шафах, холодильному та іншому спеціальному устаткуваннідля забезпечення умов зберігання лікарських засобів відповідно до чинних вимог . За наявності на аптечній базі (складі) імунобіологічних препаратів загальний обсяг холодильного обладнання повинен забезпечувати відповідно до чинних вимог зберігання всієї кількості зазначених ліків, що міститься на базі (складі). Ліцензіат при зберіганні лікарських засобів зобов'язаний виключити їх ушкодження (розливання, розсипання, розбиття), зараження мікроорганізмами та перехресної контамінації. Зберігання лікарських засобів вимагають особливих температурних умов, контрольованих пристроями постійного моніторингу температури, або термоконтейнерами.
3. Персонал. Що стосується ресурсів діє третій принцип менеджменту – це залучення працівників. Саме працівники всіх рівнів становлять основу організації. Їхнє повне залучення дає можливість організації з вигодою використовувати їх здібності. З одного боку, управлінське рішення керівництва про те, що система менеджменту має функціонувати, а з іншого боку – лише у тому випадку, коли весь персонал усвідомлює, що система менеджменту – це не проста сукупність додаткових папірців, які стоятимуть на полиці. Це має бути дієва структура, а працюватиме вона лише тоді, коли всі зрозуміють, на чому вона заснована і для чого це робиться. У кожній аптеці у тому чи іншому вигляді система менеджменту якості створена та успішно функціонує – у когось на 10%, у когось на 90%.
4. ДокументаціяОперації, що впливають якість товарів, повинні описуватися письмовими процедурами. Система менеджменту якості націлена на те, щоб систематизувати процеси, подивитися, чи всі вони забезпечені необхідними ресурсами, документами. Важливо знати, чи на всі процеси є документовані процедури та правила виконання. Процес аналізу та покращення потрібен для того, щоб приймати управлінські рішення, що ґрунтуються на фактах, – це сьомий принцип менеджменту стандартів ISO. Ефективне рішенняґрунтуються на аналізі даних та інформації.
7. Повернення. Наявність в обігу неякісних або фальсифікованих лікарських засобів, за винятком тих, термін придатності яких минув, не допускається. Виявивши факт наявності неякісних, фальсифікованих тощо лікарських засобів, суб'єкт підприємництва має скласти відповідний акт та вжити заходів щодо виключення їх з обігу. Виняток із обігу таких лікарських засобів відбувається шляхом утилізації та знищення відповідно до Правил утилізації лікарських засобів. Розроблено порядок роботи з листами Росздоровнадору про забраковану та фальсифіковану продукцію для фахівців Центру відповідно до вимог та за формами, зазначеними у листі. Федеральної службиз нагляду у сфері охорони здоров'я та соціального розвиткувід 28.09.2004. №4082/04.
5. Оптимізація системи управління якістю фармацевтичної діяльностів аптеці
В результаті вивчення літератури з управління якістю ЛВ можна запропонувати оптимізувати діяльність аптечних організацій шляхом впровадження наступних принципів:
Якість управління - поняття багатогранне, до нього входить безліч складових, таких як: прозорість і керованість процесів, якість інформації, можливість оперативного контролю поточної діяльності та багато іншого. При цьому практично єдиним інструментом здійснення управління є різні документи. Таким чином, очевидний спосіб змінити якість управління підприємством полягає у підвищенні ефективності роботи з документами.
Управління якістю діяльності аптеки спирається на наступні принципи:
Достатній асортимент та обсяг по доступним цінамЛЗ
Завданням аптеки є не що інше, як надання населенню ЛЗ та аптечних товарівв потрібному місціта у зручний для відвідувачів час, для чого визначаються потреби, постачальник, складається заявка, проводиться закупівля, вивчається дозування.
Соціальна доступність
Проведення досліджень з асортименту в межах синонімів та аналогів. В аптеці є не одне торгове найменування однієї діючої речовини. Торгові назви іноді відрізняються на 100-700%, залежно від виробника. Аптека закуповує різні торгові найменування з різним рівнем, щоб забезпечити соціальну доступність різним соціальним групамвідвідувачів. В одній фармакотерапевтичній групі можна брати і дорогі, і середньо-і низькі препарати.
Інформаційно-консультаційний супровід
Працівники аптеки повинні передбачати очікування споживача та домагатися відповідності продукту цим очікуванням. Не завжди це можливо. Наприклад, споживач хоче отримати перед покупкою лікарського засобу консультацію у фармацевта. Але фармацевт – не лікар і жодної законодавчо закріпленої відповідальності за здоров'я пацієнта у нашій країні не несе. Проте, не отримуючи очікуваного, споживач залишається незадоволеним.
Впровадження комп'ютерних систем в аптеках та використання штрих-кодів при контролі якості ліків в аптеці
Система автоматизації аптечного підприємства відрізняється систем автоматизації торгових підприємств. Аптек дуже багато своєї специфіки, в основному пов'язаної з ціноутворенням, яке в Росії завжди було складним і заплутаним процесом. Ціноутворення в аптеці виконується за певними законодавчими документами та суворо регламентовано, є перелік препаратів, які не оподатковуються. На такі медикаменти по-іншому формується роздрібна ціна. Раніше для аптечних працівників процес отримання товару та оформлення ціни був трудомістким, займав багато часу. Тому без автоматизації тут просто не обійтись.
Системи автоматизації дають можливість працівникам аптеки переглянути дані про те, що є, які медикаменти закінчилися, і що потрібно докупити. Процес швидкого перегляду реальних залишків - одне з найголовніших під час виборів системи автоматизації.
У будь-якій звичайній аптеці, де стоїть простий касовий апарат, при покупці гроші, які ми платимо в касу, ніяк не взаємопов'язані безпосередньо з тим товаром, який ми отримуємо.
І тут одразу виникає кілька проблем:
По-перше, в аптеці відсутній повноцінний та детальний облік руху товарів та фінансових засобів. Неможливо, наприклад, будь-якої миті часу сказати, скільки даного товару було продано, залишилося в торговому заліабо на складі, неможливо автоматично заборонити пробивати товар, що вже закінчився тощо;
По-друге, важко уникнути помилок, яких може припуститися касир;
По-третє, відсутність докладного обліку не дає можливості провести статистику та детальний аналіз динаміки продажів, що заважає більш гнучко реагувати на зміну попиту.
6. Аналіз та шляхи вдосконалення системи управління якістю лікарських засобів в аптеці ТОВ «МАІР»
ТОВ "МАІР" працює на фармацевтичному ринку вже понад 15 років у Приморському краї. Її аптечна мережа об'єднує 5 торгових точок та користується величезною популярністю – кілька тис. жителів м. Владивостока мають картки постійних клієнтів. Займає другий поверх 2-х поверхової будівлі. Приміщення аптеки нове, діє з травня 2010 року, відповідає всім вимогам НТД та санітарним нормам, працює з 9:00 до 20:00 без вихідних. Є вивіски про найменування аптеки та години роботи. Розташований у зручному для відвідувачів місці, поблизу автобусної зупинки.
Своєю основною місією «Маїр» вважає не так продаж ліків, реалізацію фармпрепаратів та лікарських засобів, виробів медичного призначення, скільки надання фармацевтичних послуг на високому рівніТому компанія прагне орієнтуватися на клієнта, гарантувати якість ліків, і якнайкраще обслужити покупця. Все це, поряд із цілком зрозумілим бажанням зробити свою роботу ефективнішою, змусило керівництво замислитися про впровадження системи управління якістю.
Працюючи за системою управління якістю менше року аптека може підбити деякі підсумки. Об'єктивні показники підтверджують, що впровадження системи управління якістю сприяло оптимізації оборотних засобів: підвищився обсяг продажів в аптеках мережі, зменшилася кількість малоприбуткових та неліквідних товарів, а також продуктів зі минулим терміном придатності. Збільшилася кількість постійних покупців. Аналіз їх попиту, побажань та пропозицій дозволив практично позбутися дефектури. Крім того, завдяки орієнтації персоналу на роботу з клієнтами значно зросла не лише кількість покупок у мережі, оптимізувалась їх Середня вартість. Фахівці з управління якістю в даний час відзначають, що головною і найпроблемнішою ланкою будь-якої структури управління є люди. У нашому випадку – фахівці-фармацевти. Ті, хто перебувають у безпосередньому контакті з клієнтами, відвідувачами, споживачами. Для впровадження системи управління якістю в аптеці були проведені деякі зміни в організаційній структурі та у взаєминах у колективі. Ефективна система навчання кадрів, постійний контроль за навчанням підвищили якість роботи персоналу.
В результаті аналізу даних зарубіжної та вітчизняної літератури встановлено, що питання системи управління якістю лікарських засобів у фармакологічних установах як у Росії, так і за кордоном приділяється велика увага. При вивченні основних концепцій у побудові моделей та функціонуванні систем управління якістю явне лідерство демонструють підходи, засновані на концепції загального управління якістю (TQM) та стандартах ISO серії 9000, що передбачають ряд загальних принципів: орієнтація на споживача, лідерство керівництва, процесорний підхід, системний підхід, постійне покращення, взаємовигідні відносини з постачальниками та ін.
Система управління якістю у сфері обігу лікарських засобів у Росії визначається Федеральним законом № 86 "Про лікарські засоби", Управління якістю роботи аптечних організацій ґрунтуються на принципах TQM та стандартів серії ІСО 9000 та. галузевих стандартів: ОСТ91500.05.0005-2002 "Правила оптової торгівлі лікарськими засобами. Основні положення", затверджений наказом МОЗ РФ від 15.03.2002 №80; ОСТ 91500.05.0007-2003.
Відповідно до міжнародної практики за якість продукції, що купується у постачальників, повністю відповідає аптека, лише обов'язкові вимоги до продукції визначаються законом, а всі інші умови обумовлюються в договорі між учасниками ринку.
Система управління якістю у сфері обігу лікарських засобів має бути надійною, носити попереджувальний, що не допускає надання недоброякісних фармацевтичних послуг споживачеві, а також персоніфікований характер, тобто. мати конкретних осіб, відповідальних за це.
Розглянуто деякі принципи, що дозволяють оптимізувати систему управління якістю у сфері обігу лікарських засобів в аптеці.
СПИСОК ЛІТЕРАТУРИ
Наказ МОЗ РФ від 04.03.2003. №80 «Про затвердження галузевого стандарту «Правила відпустки (реалізації) лікарських засобів в аптечних організаціях. Основні положення".
Скулкова Р.С., Ягудіна Р.І., Пархоменко Д.В. Формування системи управління якістю аптечних організацій. Нова аптека. Нормативні документи. 2005.-N 4.-С.32-37 .
Коміссінська І. Г. Сучасна концепціяменеджменту якості аптечної організації// Московські аптеки. - 2007. - №11.
Алфьорова, Т.В. Виробничий менеджмент на підприємствах фармацевтичної галузі/Т.В. Алфьорова, Е.А. Третьякова, А.В. Буйлін. - Єкатеринбург: Вид-во Інституту економіки УРО РАН, 2008. - 214с.
Москвин В.А. Еволюція у сфері управління якістю /В.А.Москвин // Інвестиції у России.2004. №5. - С. 27-28.
Лагуткіна Т.П. П ринципи управління якістю у діяльності аптечної організації // Вісник Російського університету дружби народів. 2008.-N 4.-С.36-39.
Поліський В.А. Еволюція моделей системи якості: міжнародна практика/В.А. Поліський, С.А. Мартинчик, В.Г. Запорожченко, В.З. Кучеренко// Економіка охорони здоров'я. – 2005. – №8. – С. 25-36.
Федеральний закон«Про лікарські засоби» № 86-ФЗ від 22.06.98
Другова З.К., Бітерякова А.М. Система внутрішнього контролю та якість управління // Російські аптеки. - №2. - 2007.
Кононова С.В. Система забезпечення якості фармацевтичних послуг у регіональному фармацевтичному комплексі: Монографія. -Нижній Новгород: Видавництво ВДІПА, 2003.
Умови зберігання лікарських засобів. - М.: Медицина, 2006. - 184с.
Кулаєв В. А. Єгоров В.А., Гладунова Є.П., Єжков В.М. Комплексна система управління якістю фармацевтичної допомоги // Фармація, 2011 № 3, C. 30-33
ГОУ ВПО «ПЕРМСЬКА ДЕРЖАВНА ФАРМАЦЕВТИЧНА АКАДЕМІЯ»
Кафедра управління та економіки фармації ФДПО та ФЗВ
Курси підвищення кваліфікації за заочною формою навчання
з використанням дистанційних технологій за спеціальністю «Управління та економіка фармації»
Терміни навчання (з 15.10.2010 до 14.09.2011)
Курсова роботапо темі:
“Створення системи управління якістю лікарських засобів в аптеці ”
ВИКОНАВЕЦЬ:
Фадєєва Марія Валеріївна, провізор-інтерн
База дослідження:
Аптека "МАІР"
Місто Владивосток
Перм 2011 р.
Вступ
1. Сучасний стансистеми управління якістю лікарських засобів в аптечній діяльності зарубіжних країнах…………....……5
2. Законодавча базауправління якістю лікарських засобів в аптечних організаціях за даними літератури та нормативно-правових документів ……………………………………………………………..…..10
3. Управління фармацевтичною діяльністю в аптеці …………….....12
4. Створення системи управління якістю лікарських засобів в аптеці …………………………………………………………………….....17
5. Оптимізація системи управління якістю фармацевтичної діяльності в аптеці…………………………………………………...….22
6. Аналіз та шляхи вдосконалення системи управління якістю лікарських засобів в аптеці ТОВ «МАІР» …………………...……23
Висновки ………………………………………………………………………..…25
Список використаної літератури …………………………………………..26
ВСТУП
Соціальна спрямованість фармацевтичного ринку, що забезпечує потреба у життєво важливих лікарських засобах, а отже, потреба у збереженні та зміцненні здоров'я, зумовлює необхідність розробки системи управління якістю фармацевтичних товарів і послуг, що виводяться на ринок. Основу цієї системи становить система управління якістю лікарських засобів на всіх стадіях їх життєвого циклута якістю фармацевтичної допомоги як діяльності з надання фармацевтичних послуг населенню. Якість лікарських засобів на федеральному рівні законодавчо визначено як відповідність до державного стандарту.
Сучасне функціонування російського фармацевтичного ринку характеризується асортиментом лікарських засобів (ЛЗ), що постійно розширюється, і невиправдано великою кількістю постачальників. У цих умовах особливої актуальності набуває проблема забезпечення якості лікарської допомоги, що надається населенню. Відповідно до вимог діючого галузевого стандарту «Правила відпустки (реалізації) лікарських засобів в аптечних організаціях. Основні положення» в кожній аптечній організації, що здійснює роздрібну реалізацію ЛЗ, має бути створена система управління якістю. Це зумовлено особливою професійною відповідальністю за якість лікарської допомоги, яка покладається на аптеки. На сьогоднішній день існує цілий рядпублікацій у провідних фармацевтичних виданнях, різних галузях економіки, але, на жаль, у фармації менеджмент якості та діяльність уповноваженого за якістю плутають із виконанням функціональних обов'язків провізора-аналітика.
Якщо в промисловості система управління якістю впроваджується вже давно, то у діяльності аптечної організації вона лише починає жити та працювати. До цього часу відсутні (документально) рекомендації щодо впровадження системи в аптечних організаціях, яка має вибудовуватися на підставі міжнародних стандартівякості.
Поняття якості складається із взаємовідносин виробника та споживача товару. Продукція настільки якісна, настільки вона задовольняє запити та потреби споживача. Основні властивості якості такі: невід'ємність від об'єкта (якщо говоримо про роздрібну мережу, то якість має бути присутня в кожній її точці); непостійність у часі, не можна заміряти якість один раз, оскільки змінюються фактори впливу і відповідно змінюється якість (наприклад, прийшов новий персонал, збільшилося на нього навантаження і, як наслідок, змінилася якість). Формулу якості можна висловити так: співвідношення сприйманих параметрів послуг до очікуваним замовником параметрів послуг. Якість є максимальною, якщо його показник дорівнює одиниці.
Впровадження системи управління якістю аптечної діяльності у відповідність до міжнародних вимог дозволяє відійти від ліцензування фармацевтичної діяльності. Важливіше ліцензувати спеціаліста. За наявності порушень у діяльності, яку здійснює спеціаліст, він позбавляється ліцензії, а підприємство продовжує працювати .
Крім того, сучасний етапРозвиток російського фармацевтичного ринку характеризується лавиноподібним зростанням номенклатури лікарських засобів, що вперше виводяться на ринок. Це, з одного боку, дозволяє лікарю, за умови достатньої професійної інформованості про наявність пропозицій та властивості лікарських засобів, вибрати оптимальну схему фармакотерапії захворювання, з іншого боку, ускладнює саму процедуру вибору через безліч критеріїв вибору оптимального лікарського засобу. Провізор, який займається продажем лікарських засобів, при наданні консультативної допомоги споживачам також часто стикається з певними труднощами, спричиненими недостатньою поінформованістю про фармакоекономічні характеристики нових препаратів. Щоб фахівець відповідав сучасним нормамта вимогам, необхідно чітко визначити рівень його відповідальності за доручену справу. Саме професійний рівеньфахівця має стати одним із основних елементів системи управління якістю на аптечному підприємстві.
Тому метою даної роботи є вивчення теоретичних і практичних підходів до створення системи управління якістю лікарських засобів в аптеці, а також аналіз проблем, що виникають при цьому, і вироблення шляхів їх вирішення.
Реалізація поставленої мети потребує вирішення наступних завдань:
1. Вивчення сучасного стану системи управління якістю лікарських засобів в аптечній діяльності в зарубіжних країнах та Російській Федерації
2. Розгляд теоретичних засадсистеми управління якістю лікарських засобів в аптечних організаціях за даними літератури та нормативно-правових документів.
3. Оптимізація системи управління якістю фармацевтичної діяльності у аптеці.
4. Аналіз управління якістю лікарських засобів у аптеці “МАІР” м. Владивостока.
В основу методології дослідження покладено конституційні принципи державних гарантій охорони здоров'я громадян, законодавчі та нормативні акти РФ у галузі охорони здоров'я та лікарського забезпечення, концепція ВООЗ про національну політику в галузі лікарського забезпечення, наукові праці вітчизняних та зарубіжних авторів у галузі управління та економіки фармації та охорони здоров'я та фармацевтичного менеджменту Для написання роботи також використовувалася навчальна література з дисципліни, статті зі спеціалізованих журналів, а також джерела Інтернету.
1. Сучасний стан системи управління якістю лікарських засобів в аптечній діяльності у зарубіжних країнах
Розвиваючи власну національну політику галузі лікарського забезпечення, Росія має максимально враховувати прийняті міжнародні вимоги. У спеціальному дорученні Президента Росії В.В.Путіна, даному у вересні 2003 року, наголошується на необхідності приведення в гармонію нормативних актів РФ у сфері обігу лікарських засобів з прийнятими в міжнародній практиці нормами. В основному законі у 1998 році та пізніше у 2003 році у 80-му галузевому стандарті такі поняття, як аптека (у тому числі лікарняна), аптека закладу охорони здоров'я, аптечний пункт, аптечний магазин, аптечний кіоск були названі «аптечними установами». Фактично на фармацевтичному ринку на сьогоднішній день існують два види фарморганізацій – аптечні установи, пов'язані з роздрібною торгівлею, та інші – організації оптової торгівлі ЛЗ.
І.Г. Коміссінській (2007) було детально розглянуто сучасну концепцію менеджменту якості аптечної організації у світі. Міжнародною організацією, що сприяє в розробці стандартів, правил та інших аналогічних документів, що визнаються повсюдно, з метою полегшення міжнародного обміну товарами та послугами, є ISO (ISO) - International Organization for Standartization. ISO – це скорочення грецького слова isos – «загальний». Важливо розібратися, що таке стандарти ISO, чому саме вони у всьому світі регламентують вимоги, дають основні положення та поняття у сфері системи менеджменту якості.
Історія появи стандартів ISO 9000 пов'язана з прийнятою в ЄС Глобальною концепцією законодавчого забезпечення якості товарів та послуг, яка включає: систему управління якістю у виробника; перевірку продукції у випробувальних лабораторіях; сертифікації продукції; застосування системи менеджменту якості в організаціях як гарантії стабільної якості продукції та послуг.
Світовий досвід з організації робіт у галузі менеджменту якості узагальнений та систематизований у стандартах ISO серії 9000 – це пакет документів із забезпечення якості, підготовлений 176-м комітетом Міжнародної організації зі стандартизації.
Відповідно до міжнародної практики лише обов'язкові вимоги до продукції визначаються законом, проте інші умови обумовлюються у договорі між учасниками ринку, тобто. за якість продукції, що купується у постачальників, повністю відповідає аптека. Стандарти серії ISO 9000 є міжнародним еталоном вимог до якості для комерційної діяльності. Основною їх метою є надання допомоги аптекам у визначенні потенційних постачальників, які мають ефективну систему менеджменту якості; скорочення витрат на якість у зв'язку з впевненістю у якісній діяльності постачальника; сприяння та методологічна допомога організаціям у створенні систем якості. Основними з них є: ISO 9000-2001, який називається «Система менеджменту якості. Основні положення та словник» - це основний стандарт, від якого відштовхується вся термінологія, поняття. Його логічним продовженням є ДСТУ ISO 9001-2001, який називається «Система менеджменту якості. Вимоги». На сьогоднішній день у світовій практиці існує понад 20 стандартів ІСО.
Під якістю лікарських засобів розуміють їх відповідність усім умовам реєстрації, умовам виробництва (технологія, виробничий майданчик, кадри) та заданим характеристикам. Фармацевтична продукція, як і будь-яка інша продукція, проходить різні етапи життєвого циклу (петлі якості) (рис. 1).
Рис. 1. Система забезпечення якості лікарських засобів
Поточною світовою тенденцією у сфері нормування та регулювання виробництва лікарських засобів є глобальна гармонізація вимог до виробництва ЛЗ протягом усього життєвого циклу препарату та акцент на задоволеність споживача відповідно до призначення препарату (рис. 2).
Лікарський засіб при виході на ринок із підприємства отримує сертифікат якості, підписаний уповноваженою особоювиробника, якщо воно відповідає якісним показникам реєстраційного досьє з безпеки, ефективності та вироблено відповідно до правил GMP.
При цьому присутні два явно виражені напрямки - соціальна відповідальність виробника ЛЗ, що збільшується, нав'язувана державою і суспільством в цілому і акцент на забезпечення випуску продукції належної якостіза допомогою організаційно-управлінських заходів на всіх етапах – від розробки нового препарату до реалізації готового продукту- З активною регулюючою роллю державних органів.

Рис. 2. Основні вимоги ВООЗ щодо якості лікарських засобів
Результатом роботи виконавчого комітету Наразістала розробка та прийняття документів, що відносяться до процесу створення лікарських засобів (Q8 «Pharmaceutical Development»), управління ризиками якості (Q9 «Quality Risk Management») та системи якості (Q10 «Pharmaceutical Quality Systems») (рис. 3).
Далі з позиції стандартів ISO розглянемо, що робить аптечна організація, хто й у чому зацікавлений, і як цю діяльність зробити результативнішою і ефективної. Концепція забезпечення якості лікарських засобів дає можливість глибше зрозуміти, усвідомити та виконувати зобов'язання, покладені на всіх практикуючих фармацевтів. Належна аптечна практика (good pharmaceutical practice, GPP) – це діяльність, пов'язана з постачанням, зберіганням та застосуванням лікарських засобів та виробів медичного призначення, що здійснюється в аптеках.
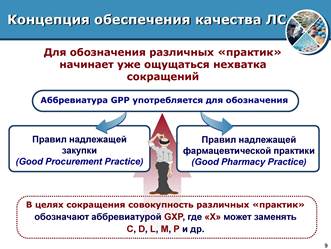
Рис.3. Правила належної аптечної практики для забезпечення якості лікарських засобів
Ініціатором нормотворчої діяльності виступають національні регулюючі органи у тісній співпраці з виробниками в особі фармацевтичних асоціацій.
Стандарт і сертифікат ISO – це два нерозривні поняття. Звичайно, можна впроваджувати систему ISO, не сертифікуючи її, але хто перевірить, наскільки правильно вона побудована? В даному випадкудіє документ під назвою «Сертифікат ISO 9000», який підтверджує відповідність системи управління якістю організації встановленим вимогам. Сертифікат на ліки – це документ, що підтверджує відповідність ЛЗ якості. Сертифікат ІСО – це документ, що підтверджує відповідність системи менеджменту якості тим вимогам, які висувають відповідні ГОСТи. Говорячи про систему управління якістю, не можна не говорити про стандарти ISO.
Основні положення системи управління якістю описані в стандарті ISO 9000. У ньому сформульовані 8 принципів управління якістю:
1. Орієнтація на споживача: розуміння його поточних та майбутніх потреб, виконання його вимог та прагнення перевершити його очікування.
2. Лідерство керівника, що забезпечує єдність мети та напрямки діяльності організації.
3. Залучення працівників, що дозволяє з вигодою використовувати їх здібності.
4. Процесний підхід до управління діяльністю та відповідними ресурсами.
5. Системний підхід до управління: виявлення, розуміння та управління взаємопов'язаними процесами як системою роблять внесок у результативність та ефективність організації при досягненні її цілей.
6. Постійне поліпшення діяльності організації.
7. Прийняття рішень, заснованих на аналізі даних та інформації.
8. Взаємовигідні відносини із постачальниками.
Досягнення цілей у сфері якості може позитивно впливати на якість продукції, ефективність роботи та фінансові показники і, отже, на задоволеність та впевненість зацікавлених сторін.
До основних положень системи управління якістю належить документація, яка дає можливість передати зміст та послідовність дій.
Нині не передбачається забезпечення тількиякості продукції, а поставлена цільзадоволення споживачів шляхом виконання та перевиконання їхніх вимог за допомогою впровадження ефективних систем менеджменту якості, постійного підвищення її ефективності, а також попередження невідповідностей між очікуваннями споживачів та якістю запропонованої ним продукції та послуг.
Найбільш методологічно сильною, ефективною та популярною в даний час визнана загальна модель управління якістю (Total Quality Management – TQM), в основі якої лежить реалізація таких принципів як: орієнтація на споживача, лідерство керівника, залучення всього персоналу у вирішення проблем якості, системний та процесний підхіддо управління, постійне вдосконалення виробництва, взаємовигідне співробітництво, прийняття рішень, що ґрунтуються на фактах .
2. Законодавча база управління якістю лікарських засобів в аптечних організаціях за даними літератури та нормативно-правових документів
Важливо розглянути, які основні стандарти існують у Росії, які їх дають розшифровку основних понять і визначень, який стандарт пред'являє вимоги у процесі сертифікації організації та системи менеджменту якості. Від Росії у діяльності ІСО бере участь державний орган– Держстандарт Росії.
У зв'язку з інтеграцією у світове співтовариство комплекс стандартів ISO враховується і впроваджується в Росії, де на основі цих стандартів були розроблені:
ДСТУ ISO 9000-2001 описує основні положення і містить термінологію, що відноситься до системи менеджменту якості.
ДСТУ ISO 9001-2001 визначає вимоги до системи менеджменту якості
Стандарт (ГОСТ Р ИСО 9004-2001) називається «Система управління якістю. Рекомендації щодо покращення діяльності». Стандарти 9001 і 9004 цілком ідентичні структурі, але стандарт 9001 чіткіший і лаконічний. Стандарт 9004 базується на стандарті 9001, містить ті ж розділи, але в розгорнутій формі, з поясненнями та доповненнями. Відбиває як те що, як створити систему менеджменту якості, отримати неї сертифікат ІСО, а й використовуватиме поліпшення діяльності організації. Усі три зазначені стандарти тісно взаємопов'язані.
Діюча система управління якістю розроблена та впроваджена строго відповідно до вимог національних стандартів РФ ГОСТ Р 52249-2009 (GMP) «Правила виробництва та контролю якості лікарських засобів» та ГОСТ Р ІСО 9001-2008 (ІСО 9001:2008) «Системи менеджменту якості. Вимоги».
Російський стандарт GMP був підготовлений Асоціацією інженерів із контролю мікрозабруднень (АСИНКОМ). У 2004 році був затверджений Постановою Держстандарту Росії т 10 березня 2004 № 160-ст ГОСТ Р 52249-2004 "Правила виробництва та контролю якості лікарських засобів", який гармонізований з правилами GMP (Good Manufacturing Practice for medicinal products) Європейського Союзу. Наказ МОЗ та Мінекономіки введений у дію з 1 січня 2005 року, і дотримання правил GMP у фармацевтичному виробництві в Російській федерації є обов'язковим.
Забезпечення якості лікарських засобів (ЛЗ) – одне з найважливіших завдань сучасної фармації. Для стандартизації та уніфікації процесу забезпечення якості ЛЗ на етапі безпосереднього їх надходження до пацієнтів (роздрібна ланка розподілу ЛЗ) визнається необхідним використанняпринципів та методів стандартів "Належна Аптечна Практика" (Good Pharmacy Practice -GPP). Аптечна організація з точки зору стандартів ІСО – це група працівників та необхідних коштівз розподілом відповідальності, повноважень та взаємовідносин, які здійснюють фармацевтичну діяльність на аптечних об'єктах на кшталт аптеки, пункту, кіоску, магазину тощо. .
Необхідною умовою при здійсненні фармацевтичної діяльності є забезпечення якості на підприємствах оптової торгівлі та в аптечних організаціях, що відбилося в ОСТах. Першим кроком, що дозволяє створити сучасну правову базурегулювання фармацевтичного ринку з урахуванням міжнародних норм, є прийняття таких галузевих стандартів:
ОСТ91500.05.0005-2002 "Правила оптової торгівлі лікарськими засобами. Основні положення", затверджений наказом МОЗ РФ від 15.03.2002 №80;
ОСТ 91500.05.0007-2003 "Правила відпустки (реалізації) лікарських засобів в аптечних організаціях. Основні положення", затверджений наказом МОЗ РФ від 04.03.2003 №80.
3. Системи управління якістю фармацевтичної діяльності в аптеці
Проблеми створення ефективної системи управління якістю лікарських засобів (ЛЗ) у аптеці знайшли свій відбиток у публікаціях низки вітчизняних учених: Д.В. Пархоменко, І.Г. Коміссінської, З.К. Інший, А.М. Бітерякова, С.В. Кононова та ін.
Система – це сукупність взаємозалежних та взаємодіючих принципів. У кожній системі є так званий вхід - тобто процеси та матеріальні цінності, що ініціюють дії, усередині системи відбуваються свої процеси. Система управління якістю у сфері обігу лікарських засобів у Росії визначається Федеральним законом № 86 "Про лікарські засоби", та її основними етапами є реєстрація лікарського засобу, ліцензування виробництва лікарського засобу та ліцензування фармацевтичної діяльності .
Відповідно до ст.45 цього закону на працівників аптеки покладається особлива професійна відповідальність за надання споживачеві якісної лікарської допомоги. Збитки, пов'язані зі шкодою здоров'ю, завданими внаслідок застосування ЛЗ, які стали непридатними внаслідок порушень правил фармацевтичної діяльності, відшкодовуються організацією, з вини якої було допущено порушення.
Складність, багатоетапність і тривалість "життєвого циклу ЛЗ" - від їх створення до отримання кінцевим споживачем - визначають необхідність запровадження дієвої системи управління якістю ЛЗ запобіжного характеру, що не допускає проникнення на фармацевтичний ринок недоброякісних ЛЗ. На шляху ЛЗ від виробника до споживача останньою ланкою, де якість ЛЗ оцінюється кваліфікованими фахівцями, є аптека. Управління якістю роботи аптечних організацій ґрунтуються на принципах TQM та стандартів серії ISO 9000.
В аптечних установахмає бути сформована система управління якістю, однією з функцій якої є контроль за дотриманням вимог нормативних документів системи стандартизації у охороні здоров'я, зокрема вищезгаданих ОСТів. Основною метою створення ефективної системи управління якістю лікарських засобів (ЛЗ) та фармацевтичної діяльності в умовах аптеки є забезпечення можливості придбання споживачем доброякісних ЛЗ та отримання високоякісного лікарського обслуговування .
ОСТ 91500.05.0007-2003 «Правила відпустки (реалізації) ЛЗ в аптечних організаціях, основні положення» (затверджений Наказом МОЗ України) регламентує правила роздрібної реалізації в аптечних організаціях, у розділі 9, пункті 9.1 сказано: «В аптечній організації має бути сформована система управління якістю». У пункті 9.9 зазначено: "Керівник аптечної організації призначає з керівного персоналу уповноваженого за якістю".
Фармацевтичні послуги мають високу споживчу вартість, оскільки є одним з видів інтелектуальних послуг, що сприяють підтримці та збереженню здоров'я людини. Висока споживча вартість визначає правомірність високих цін на ці послуги.
Результати послуг мають, як правило, відстрочений та диференційований характер, що визначає особливий підхіддо формування цін послуги та особливий режим фінансування фармацевтичних організацій. Споживачем фармацевтичних послуг є і окрема особистість, і суспільство загалом.
Ці особливості визначають двоїстий підхід до проблеми якості фармацевтичних послуг. По-перше, удосконалення якості є одним із головних факторів конкурентної переваги фармацевтичної організації та отримання максимального прибутку. Саме тому проблема якості фармацевтичних послуг починає у центрі економічних інтересів організації та дозволяє посилювати її економічну стійкість. З іншого боку, якість фармацевтичних послуг – це найважливіша умовавиконання ними своєї соціальної функції – забезпечення якісної фармацевтичної допомоги, а зрештою – підтримання здоров'я людини. Фармацевтична організація може вважати, що досягла поставлених цілей та завдань, лише в тому випадку, коли забезпечила високий рівень якості послуг. Саме тому потрібний розвиток системи якості в організації, вірніше системи управління (менеджменту) якістю.
Якість фармацевтичних послуг складається з двох основних складових: якість лікарських засобів (ЛЗ)і якість фармацевтичної діяльності.
Якість лікарських засобіввизначається такими складовими :
визначення потреб ринку (якість вибору споживача);
Якість проектування антибіотиків;
Якість процесу виробництва;
Відповідність якості кінцевої продукції проекту;
Якість післяпродажного обслуговування.
До основних властивостей, що визначають якість фармацевтичних та медичних товарів, належать:
безпека- стан товару в звичайних умовахйого використання, зберігання, транспортування та утилізації, при якому ризик шкоди для життя, здоров'я та майна споживача обмежений допустимим рівнем.
функціональні властивості . Вони визначають придатність продукції виконувати свої функції за призначенням у заданих умовах експлуатації чи споживання.
Н надійність. У багатьох випадках безпека виробу визначається його надійністю, тобто. властивістю довго зберігати свої первісні характеристики у певних межах у процесі експлуатації.
екологічність. Вона характеризує ступінь шкідливого впливумедичних товарів на навколишнє середовище, що виникає на стадії всього терміну дії продукції Показники екологічності: рівень небезпечних хімічних виділень, випромінювань, концентрація шкідливих речовина також здатність до повторної переробки.
естетичність- показник якісної та кількісної оцінки естетичної цінності виробів залежно від групи споживачів, конкретних умов споживання та призначення продукції.
ресурсоспоживання. Воно характеризується витратами споживача придбання, експлуатацію та обслуговування вироби період середнього технічного ресурсу, тобто. до зняття виробу з експлуатації.
Оцінка якості лікарських засобів
Якість ЛЗ оцінюється відповідно до Інструкції з оцінки якості лікарських засобів, що виготовляються в аптеках (наказ МОЗ України від 16.10.97 № 305) «Про норми відхилень, допустимі при виготовленні лікарських засобів та фасування промислової продукції в аптеках»). Цей наказ поширюється на всі аптеки, аптечні пункти (з правом виготовлення ЛЗ) та територіальні контрольно-аналітичні лабораторії, що здійснюють контроль якості ЛЗ, що виготовляються в аптеках.
Якість ЛЗ (у тому числі гомеопатичних), що виготовляються в аптеках, встановлюється за комплексом показників. Рівень якості ЛЗ оцінюється відповідно до вимог, регламентованих діючими ДФ, наказами та інструкціями МОЗ Росії.
Для оцінки якості застосовуються терміни «Задовольняє» («Дічна продукція») та «Не задовольняє» («Шлюб»). Рівень якості виготовлених ЛЗ визначається органолептичним та вимірювальними методами.
Незадовільність виготовлених ЛЗ встановлюється за такими показниками:
· Невідповідність за описом ( зовнішній вигляд, колір, запах);
· невідповідність по прозорості чи кольоровості;
· невідповідність щодо розпаду;
· неоднорідність з подрібненості або змішування порошків, мазей, супозиторіїв, гомеопатичних тритурацій;
· Наявність видимих механічних включень;
· Невідповідність пропису по справжності;
· хибна заміна одного Л В іншим, відсутність прописаної або наявність непрописаної речовини;
· Заміна ЛЗ на аналогічні по фармакологічній діїбез позначення цієї заміни на вимогу, рецепт (копії рецепту, етикетці);
· Відхилення від пропису за масою або обсягом;
· Відхилення за загальною масою (обсягом);
· Відхилення за масою окремих доз та їх кількості;
· Відхилення за масою навішування (або по концентрації) окремих ЛВ;
· Невідповідність за величиною рН;
· Невідповідність за величиною щільності;
· невідповідність щодо стерильності;
· Невідповідність по мікробіологічній чистоті;
· Порушення фіксованості закупорювання (для стерильних ЛФ);
· Порушення правил оформлення ЛЗ, призначених до відпустки.
Зміни у складі ЛФ (якщо необхідно) повинні проводитися лише за згодою лікаря та повинні відзначатись на вимогі, рецепті (копії рецепту, етикетці). За відсутності зазначеної позначки на вимогу, рецепт (копії рецепту, етикетці), якість виготовлення ЛФ оцінюється «Незадовільно».
Зміни у кількості відпущеного ЛЗ або відпуск таблеток замість порошків повинні також відзначатись на вимогі, рецепті та ін.
При визначенні відхилень у ЛФ слід використовувати вимірювальні засоби того ж типу (з однаковими метрологічними характеристиками), що і при їх виготовленні в аптеках.
Встановлено норми відхилень, допустимі під час виготовлення ЛФ (зокрема гомеопатичних) в аптеках (наказ МОЗ Росії від 16.10.97 № 305).
При визначенні допустимих відхилень у ЛС, що перевіряються, виготовлених у вигляді серій внутрішньоаптечних заготовок, слід користуватися вищевказаними нормами відхилень, а так само діючою нормативною документацією, що регламентує виготовлення і контроль якості різних лікарських форм в аптеках.
Якість фармацевтичної діяльності
Ринок фармацевтичних послуг має чітко виражені територіальні межі. У ході функціонування фармацевтичного ринку необхідний контроль з боку держави, тому що фармацевтичні послуги є суспільним благом і необхідно уникнути їх монополізації. Держава виконує функції, що стосуються переважно нормативно-правового регулювання, інформаційного забезпечення та інших аспектів розвитку ринку. Таким чином, ми можемо говорити про якусь подвійну природу фармацевтичних послуг. З одного боку вони є товар, що має свою споживчу вартість і здатний виступати суб'єктом ринкових відносин. Реалізація, у разі, повинна мати комерційний характері і переслідувати мета - отримання максимальної прибыли.
З іншого боку, фармацевтичні послуги є громадське благо,відмінними характеристиками якого є неподільність, спільний характер споживання, висока соціальна значимість, переважання суспільно-державної власності у їхньому виробництві та споживанні. З погляду споживача, фармацевтичні організації надають комплексну послугу, задовольняючи найважливіші соціальні потреби як окремої особистості, так і суспільства в цілому. Важливою особливістює також те, що надання фармацевтичних послуг вимагає дотримання певних морально-етичних норм. Все це ускладнює кількісну оцінкудіяльності, що обмежує застосування у фармацевтичній діяльності комерційних принципів діяльності.
З цього випливає, що під системою управління якістю ЛЗ, як правило, розуміють, комплекс організаційних заходів, що забезпечують надання споживачеві якісної лікарської допомоги, що є сукупністю якості самих ЛЗ та якості фармацевтичної діяльності аптечної організації. Ситуація, що склалася у сфері управління якістю, вимагає розробки практичних підходів та принципів управління до вирішення проблеми забезпечення доступності якісних ЛЗ населенню в кожній аптечній організації.
4. Створення системи управління якістю
лікарських засобів в аптеці
Наказ МОЗ РФ №80 від 04.03.2003 «Про затвердження Галузевого стандарту «Правила відпустки (реалізації) лікарських засобів в аптечних організаціях. Основні положення". Містить розділ IX Забезпечення якості лікарських засобів (лікарських засобів) в аптечних організаціях.
В аптечних організаціях або в індивідуальних підприємців має бути створена система забезпечення якості, що включає:
Приміщення та обладнання, що відповідають обсягу діяльності аптечного об'єкта та що дозволяє забезпечити дотримання умов зберігання та виготовлення ЛЗ;
Документацію, що дозволяє ідентифікувати походження, кількість і якість вступників і вести облік ЛЗ, що зберігаються і реалізуються;
Вхідний контроль вступників до аптечної організації або індивідуальному підприємцюЛЗ;
Персонал необхідної кваліфікації;
Систему безперервного навчання персоналу;
Посадові інструкції;
Фонд нормативних та довідкових матеріалів, якими мають бути забезпечені всі аптечні об'єкти цієї аптечної організації.
В аптечній організації має бути сформована система управління якістю аптечної організації.
Кожна аптечна організація повинна мати правила внутрішнього трудового розпорядку, затверджені керівником організації з відміткою про ознайомлення працівників. Перегляд правил та повторне ознайомлення з ними працівників аптечної організації провадиться щорічно.
Аптечною організацією повинні регулярно проводитись внутрішні перевірки на відповідність вимогам ГОСТу. При проведенні перевірок слід звертати увагу на наявність в аптечній організації відповідних документів на приміщення, посадових інструкцій співробітників, стандартів, інших необхідних документів.
Перевірки можуть проводитися як працівниками аптечної організації незалежними від осіб, які безпосередньо здійснюють діяльність, що перевіряється, так і незалежними експертами. Частота перевірок визначається самою аптечною організацією. Результати перевірок протоколюються і доводяться до відома персоналу, відповідального за ділянку роботи, що перевіряється, і керівництва аптечної організації. При наступних перевірках контролюється виконання рекомендацій та його ефективність. Кожен співробітник аптечної організації може бути ознайомлений з ГОСТом, порядком виконання закріплених його обов'язків, нормативними правовими актами і стандартами, які стосуються діяльності організації. В аптечних організаціях кожного співробітника мають бути посадові інструкції, затверджені у порядку.
В аптечних організаціях має бути передбачена система постійного підвищення професійної освіти працівників з питань чинного законодавства, застосування лікарських засобів та ін. План та теми занять затверджуються керівником аптечної організації. Керівник аптечної організації призначає із керівного персоналу уповноваженого за якістю.
У цьому немає сумнівів необхідність постійного вдосконалення професійних навичок фармацевтичних кадрів. Одним із шляхів вирішення цього завдання є підвищення ефективності системи післядипломної підготовки провізорів.
Аптечна організація забезпечує ведення документації відповідно до законодавчих та нормативних правових актів Російської Федерації.
Насамперед завдання аптеки – надання збережених характеристик товарів, що надійшли в аптечну організацію. Це дві групи: функціональні якості – ефективність та безпека, фізичні та фізико-хімічні, що вимагають дотримання правил поводження з ними. В рамках системи управління якістю аптечної організації в кожній аптеці повинен бути організований:
1. Приймальний контроль. Він проводиться з метою запобігання надходженню та реалізації через аптечну мережу фальсифікованої, забракованої та недоброякісної продукції. Він регламентований Галузевим стандартом ОСТ 91500.05.0007.-2003 "Правила відпустки (реалізації) лікарських засобів в аптечних організаціях". Зони (приміщення) приймання лікарських засобів та відпустки повинні бути відокремлені від зони зберігання та повинні забезпечувати належний (надійний) захист отриманих лікарських засобів від негоди під час вантажно-розвантажувальних робіт. Отримана продукція підлягає контролю якості. Результати вхідного контролю мають бути зареєстровані відповідно до встановленого в аптечному закладі внутрішнього порядку. Під час розвантаження продукції проводять перевірку на її відповідність замовлення та відсутність пошкоджень упаковок чи тари. Не підлягають прийманню лікарські препарати та інші товари, дозволені до реалізації з аптечних організацій, з термінами придатності, що закінчилися, не відповідають вимогам до якості, стандартам і без документів, що засвідчують їх якість. На лікарські препарати (лікарські засоби) у пошкодженій упаковці, що не мають сертифікатів та/або необхідної супровідної документації, забраковані при прийманні або відпустці хворому, що не відповідають замовленню або з терміном придатності, що закінчився, складається акт; вони повинні бути відповідним чином промарковані та поміщені у спеціально виділену зону окремо від інших лікарських засобів до їх ідентифікації, повернення постачальнику або знищення в установленому порядку. Отруйні та сильнодіючі речовини, наркотичні засоби, психотропні речовини, термолабільні лікарські препарати необхідно негайно розміщувати у місцях зберігання відповідно до вимог даного OCTa.
Кількість лікарських препаратів, що вимагаються особливих умов зберігання, повинна відповідати наявній ємності спеціального обладнання. Прийняті лікарські препарати та інші товари, дозволені до відпустки з аптечних організацій, приходять протягом термінів, відведених по прийманню товару за кількістю товарних одиниць та комплектності в установленому порядку. 6. Усі поставки товару повинні супроводжуватися документами, що дозволяють встановити дату відвантаження, найменування лікарського препарату (включаючи лікарську форму та дозування), номер серії та партії, кількість поставленого товару, ціну відпущеного лікарського препарату, назву та адресу постачальника та одержувача, а також документами, що підтверджують якість лікарських препаратів. Документами, що підтверджують якість лікарських засобів, є декларація про відповідність або сертифікат відповідності.
Приймальний контроль, поряд з перевіркою правильності оформлення документів, включає перевірку лікарських засобів за показниками «Опис», «Упаковка», «Маркування», що визначено вимогами наказу МОЗ РФ від 16.07.97. № 214 "Про контроль якості лікарських засобів, що виготовляються в аптечних організаціях (аптеках)". Контроль за показником "Опис" включає перевірку зовнішнього вигляду, кольору, запаху. Невідповідність за кольором, наявності стороннього запаху, осаду, пластівців, механічних включень, замерзання, розшарування є підставами для забраковування. У разі сумніву як лікарські засоби зразки направляються до територіального центру контролю якості лікарських засобів. Такі лікарські засоби з позначенням: «Зібраковано при приймальному контролі» зберігаються в аптеці ізольовано від інших лікарських засобів. Контроль за показником «Упаковка» включає перевірку цілісності упаковки, наявність вторинної упаковки, відповідність упаковки фізико-хімічним властивостям лікарських засобів.
2. Приміщення та обладнання.Основні вимоги щодо організації зберігання лікарських засобів та виробів медичного призначення в аптечних установах встановлені Інструкцією з організації зберігання в аптечних закладах різних груп лікарських засобів та предметів медичного призначення. Лікарські засоби, які потребують особливих умов зберігання, повинні бути негайно ідентифіковані та розміщені у відповідних приміщеннях (зонах) зберіганнязгідно з вимогами чинного законодавства. Приміщення для зберігання в аптеці має бути досить просторим, щоб забезпечити впорядковане зберігання різних категорій матеріалів та продуктів. Чистим та захищеним. Лікарські засоби у виробничих складських приміщеннях повинні зберігатися на стелажах, піддонах, підтоварниках, шафах, холодильному та іншому спеціальному обладнанні для забезпечення умов зберігання лікарських засобів відповідно до чинних вимог. . За наявності на аптечній базі (складі) імунобіологічних препаратів загальний обсяг холодильного обладнання повинен забезпечувати відповідно до чинних вимог зберігання всієї кількості зазначених ліків, що міститься на базі (складі). Ліцензіат при зберіганні лікарських засобів зобов'язаний виключити їх ушкодження (розливання, розсипання, розбиття), зараження мікроорганізмами та перехресної контамінації. Зберігання лікарських засобів вимагають особливих температурних умов, контрольованих пристроями постійного моніторингу температури, або термоконтейнерами.
3. Персонал. Що стосується ресурсів діє третій принцип менеджменту – це залучення працівників. Саме працівники всіх рівнів становлять основу організації. Їхнє повне залучення дає можливість організації з вигодою використовувати їх здібності. З одного боку, управлінське рішення керівництва про те, що система менеджменту має функціонувати, а з іншого боку – лише у тому випадку, коли весь персонал усвідомлює, що система менеджменту – це не проста сукупність додаткових папірців, які стоятимуть на полиці. Це має бути дієва структура, а працюватиме вона лише тоді, коли всі зрозуміють, на чому вона заснована і для чого це робиться. У кожній аптеці у тому чи іншому вигляді система менеджменту якості створена та успішно функціонує – у когось на 10%, у когось на 90%.
4. ДокументаціяОперації, що впливають якість товарів, повинні описуватися письмовими процедурами. Система менеджменту якості націлена на те, щоб систематизувати процеси, подивитися, чи всі вони забезпечені необхідними ресурсами, документами. Важливо знати, чи на всі процеси є документовані процедури та правила виконання. Процес аналізу та покращення потрібен для того, щоб приймати управлінські рішення, що ґрунтуються на фактах, – це сьомий принцип менеджменту стандартів ISO. Ефективні рішення ґрунтуються на аналізі даних та інформації.
7. Повернення. Наявність в обігу неякісних або фальсифікованих лікарських засобів, за винятком тих, термін придатності яких минув, не допускається. Виявивши факт наявності неякісних, фальсифікованих тощо лікарських засобів, суб'єкт підприємництва має скласти відповідний акт та вжити заходів щодо виключення їх з обігу. Виняток із обігу таких лікарських засобів відбувається шляхом утилізації та знищення відповідно до Правил утилізації лікарських засобів. Розроблено порядок роботи з листами Росздравнадора про забраковану та фальсифіковану продукцію для фахівців Центру відповідно до вимог та за формами, зазначеними у листі Федеральної служби з нагляду у сфері охорони здоров'я та соціального розвитку від 28.09.2004. №4082/04.
5. Оптимізація системи управління якістю фармацевтичної діяльності в аптеці
В результаті вивчення літератури з управління якістю ЛВ можна запропонувати оптимізувати діяльність аптечних організацій шляхом впровадження наступних принципів:
Якість управління - поняття багатогранне, до нього входить безліч складових, таких як: прозорість і керованість процесів, якість інформації, можливість оперативного контролю поточної діяльності та багато іншого. При цьому практично єдиним інструментом здійснення управління є різні документи. Таким чином, очевидний спосіб змінити якість управління підприємством полягає у підвищенні ефективності роботи з документами.
Управління якістю діяльності аптеки спирається на такі принципи:
· Достатній асортимент та обсяг за доступними цінами ЛЗ
Завданням аптеки є не що інше, як надання населенню ЛЗ та аптечних товарів у потрібному місці та у зручний для відвідувачів час, для чого визначаються потреби, постачальник, складається заявка, проводиться закупівля, вивчається дозування.
· Соціальна доступність
Проведення досліджень з асортименту в межах синонімів та аналогів. В аптеці є не одне торгове найменування однієї діючої речовини. Торгові назви іноді відрізняються на 100-700%, залежно від виробника. Аптека закуповує різні торгові назви з різним рівнем, щоб забезпечити соціальну доступність різним соціальним групам відвідувачів. В одній фармакотерапевтичній групі можна брати і дорогі, і середньо-і низькі препарати.
- Інформаційно-консультаційний супровід
Працівники аптеки повинні передбачати очікування споживача та домагатися відповідності продукту цим очікуванням. Не завжди це можливо. Наприклад, споживач хоче отримати перед покупкою лікарського засобу консультацію у фармацевта. Але фармацевт – не лікар і жодної законодавчо закріпленої відповідальності за здоров'я пацієнта у нашій країні не несе. Проте, не отримуючи очікуваного, споживач залишається незадоволеним.
- Впровадження комп'ютерних систем в аптеках та використання штрих-кодів при контролі якості ліків в аптеці
Система автоматизації аптечного підприємства відрізняється систем автоматизації торгових підприємств. Аптек дуже багато своєї специфіки, в основному пов'язаної з ціноутворенням, яке в Росії завжди було складним і заплутаним процесом. Ціноутворення в аптеці виконується за певними законодавчими документами та суворо регламентовано, є перелік препаратів, які не оподатковуються. На такі медикаменти по-іншому формується роздрібна ціна. Раніше для аптечних працівників процес отримання товару та оформлення ціни був трудомістким, займав багато часу. Тому без автоматизації тут просто не обійтись.
Системи автоматизації дають можливість працівникам аптеки переглянути дані про те, що є, які медикаменти закінчилися, і що потрібно докупити. Процес швидкого перегляду реальних залишків - одне з найголовніших під час виборів системи автоматизації.
У будь-якій звичайній аптеці, де стоїть простий касовий апарат, при покупці гроші, які ми платимо в касу, ніяк не взаємопов'язані безпосередньо з тим товаром, який ми отримуємо.
І тут одразу виникає кілька проблем:
По-перше, в аптеці відсутній повноцінний та детальний облік руху товарів та фінансових засобів. Неможливо, наприклад, будь-якої миті часу сказати, скільки даного товару було продано, залишилося в торговому залі або на складі, неможливо автоматично заборонити пробивати товар, який вже закінчився і т.д.;
По-друге, важко уникнути помилок, яких може припуститися касир;
По-третє, відсутність докладного обліку не дає можливості провести статистику та детальний аналіз динаміки продажів, що заважає більш гнучко реагувати на зміну попиту.
6. Аналіз та шляхи вдосконалення системи управління якістю лікарських засобів в аптеці ТОВ «МАІР»
ТОВ "МАІР" працює на фармацевтичному ринку вже понад 15 років у Приморському краї. Її аптечна мережа об'єднує 5 торгових точок та користується величезною популярністю – кілька тис. мешканців м. Владивостока мають картки постійних клієнтів. Займає другий поверх 2-х поверхової будівлі. Приміщення аптеки нове, діє з травня 2010 року, відповідає всім вимогам НТД та санітарним нормам, працює з 9:00 до 20:00 без вихідних. Є вивіски про найменування аптеки та години роботи. Розташований у зручному для відвідувачів місці, поблизу автобусної зупинки.
Своєю основною місією «Маїр» вважає не так продаж ліків, реалізацію фармпрепаратів і лікарських засобів, виробів медичного призначення, скільки надання фармацевтичних послуг на високому рівні, тому компанія прагне орієнтуватися на клієнта, гарантувати якість ліків, і якнайкраще обслужити покупця. Все це, поряд із цілком зрозумілим бажанням зробити свою роботу ефективнішою, змусило керівництво замислитися про впровадження системи управління якістю.
Працюючи за системою управління якістю менше року аптека може підбити деякі підсумки. Об'єктивні показники підтверджують, що впровадження системи управління якістю сприяло оптимізації оборотних засобів: підвищився обсяг продажів в аптеках мережі, зменшилася кількість малоприбуткових та неліквідних товарів, а також продуктів із терміном придатності, що минув. Збільшилася кількість постійних покупців. Аналіз їх попиту, побажань та пропозицій дозволив практично позбутися дефектури. Крім того, завдяки орієнтації персоналу на роботу з клієнтами значно зросла не лише кількість покупок у мережі, оптимізувалася їхня середня вартість. Фахівці з управління якістю в даний час відзначають, що головною і найпроблемнішою ланкою будь-якої структури управління є люди. У нашому випадку – фахівці-фармацевти. Ті, хто перебувають у безпосередньому контакті з клієнтами, відвідувачами, споживачами. Для впровадження системи управління якістю в аптеці були проведені деякі зміни в організаційній структурі та у взаєминах у колективі. Ефективна система навчання кадрів, постійний контроль за навчанням підвищили якість роботи персоналу.
1. У результаті аналізу даних зарубіжної та вітчизняної літератури встановлено, що питання системи управління якістю лікарських засобів у фармакологічних установах як у Росії, так і за кордоном приділяється велика увага. При вивченні основних концепцій у побудові моделей та функціонуванні систем управління якістю явне лідерство демонструють підходи, засновані на концепції загального управління якістю (TQM) та стандартах ISO серії 9000, що передбачають ряд загальних принципів: орієнтація на споживача, лідерство керівництва, процесорний підхід, системний підхід, постійне поліпшення, взаємовигідні відносини з постачальниками та ін.
2. Система управління якістю у сфері обігу лікарських засобів у Росії визначається Федеральним законом № 86 "Про лікарські засоби", Управління якістю роботи аптечних організацій ґрунтуються на принципах TQM та стандартів серії ІСО 9000 та. галузевих стандартів: ОСТ91500.05.0005-2002 "Правила оптової торгівлі лікарськими засобами. Основні положення", затверджений наказом МОЗ РФ від 15.03.2002 №80; ОСТ 91500.05.0007-2003.
3. Відповідно до міжнародної практики за якість продукції, що купується у постачальників, повністю відповідає аптека, лише обов'язкові вимоги до продукції визначаються законом, а всі інші умови обумовлюються в договорі між учасниками ринку.
4. Система управління якістю у сфері обігу лікарських засобів має бути надійною, носити запобіжний, що не допускає надання недоброякісних фармацевтичних послуг споживачеві, а також персоніфікований характер, тобто. мати конкретних осіб, відповідальних за це.
5. Розглянуто деякі принципи, що дозволяють оптимізувати систему управління якістю у сфері обігу лікарських засобів в аптеці.
СПИСОК ЛІТЕРАТУРИ
1. Наказ МОЗ РФ від 04.03.2003. №80 «Про затвердження галузевого стандарту «Правила відпустки (реалізації) лікарських засобів в аптечних організаціях. Основні положення".
2. Скулкова Р.С., Ягудіна Р.І., Пархоменко Д.В. Формування системи управління якістю аптечних організацій. Нова аптека. Нормативні документи. 2005.-N 4.-С.32-37.
3. Коміссінська І. Г. Сучасна концепція менеджменту якості аптечної організації // Московські аптеки. - 2007. - №11.
4. Алфьорова, Т.В. Виробничий менеджмент на підприємствах фармацевтичної галузі/Т.В. Алфьорова, Е.А. Третьякова, А.В. Буйлін. - Єкатеринбург: Вид-во Інституту економіки УРО РАН, 2008. - 214с.
5. Москвин В.А. Еволюція у сфері управління якістю /В.А.Москвин // Інвестиції у России.2004. №5. - С. 27-28.
6. Лагуткіна Т.П. Принципи управління якістю діяльності аптечної організації // Вісник Російського університету дружби народів. 2008.-N 4.-С.36-39.
7. Поліський В.А. Еволюція моделей системи якості: міжнародна практика/В.А. Поліський, С.А. Мартинчик, В.Г. Запорожченко, В.З. Кучеренко// Економіка охорони здоров'я. – 2005. – №8. – С. 25-36.
8. Федеральний закон «Про лікарські засоби» № 86-ФЗ від 22.06.98
9. Другова З.К., Бітерякова А.М. Система внутрішнього контролю та якість управління // Російські аптеки. – №2. – 2007.
10. Кононова С.В. Система забезпечення якості фармацевтичних послуг у регіональному фармацевтичному комплексі: Монографія. -Нижній Новгород: Видавництво ВДІПА, 2003.
11. Умови зберігання лікарських засобів. - М.: Медицина, 2006. - 184с.
12. Кулаєв В. А. Єгоров В.А., Гладунова Є.П., Їжков В.М. Комплексна система управління якістю фармацевтичної допомоги // Фармація, 2011 № 3, C. 30-33
I. Приймальний контроль
a. Приймальний контроль проводиться з метою запобігання надходженню в аптеку неякісних лікарських засобів.
b. Приймальний контроль полягає у перевірці лікарських засобів, що надходять, на відповідність вимогам за показниками: «Опис»; "Упаковка"; "Маркування"; у перевірці правильності оформлення розрахункових документів (рахунків), а також наявності сертифікатів відповідності виробника та інших документів, що підтверджують якість лікарських засобів відповідно до чинних нормативними документами.
i. Контроль за показником "Опис" включає перевірку зовнішнього вигляду, кольору, запаху. У разі сумніву як лікарські засоби зразки направляються до територіальної контрольно-аналітичної лабораторії. Такі лікарські засоби з позначенням: «Зібраковано при приймальному контролі» зберігаються в аптеці ізольовано від інших лікарських засобів.
ii. При перевірці за показником «Упаковка» особлива увага звертається на її цілісність та відповідність фізико-хімічним властивостям лікарських засобів.
iii. При контролі за показником «Маркування» звертається увага на відповідність оформлення лікарських засобів чинним вимогам.
iv. Особливу увагуслід звертати на відповідність маркування первинної, вторинної та групової упаковки, наявність листівки-вкладиша російською мовою в упаковці (або окремо в пачці на всю кількість готових лікарських засобів).
v. На етикетках упаковки з лікарськими речовинами, призначеними для виготовлення розчинів для ін'єкції та інфузій, має бути вказівка «Придатний для ін'єкцій». Упаковки з отруйними та наркотичними лікарськими засобами повинні бути оформлені відповідно до вимог законодавства Російської Федерації та нормативних документів.
vi. Лікарська рослинна сировина, що надійшла від населення, перевіряється за показником Зовнішні ознаки» відповідно до вимог Державної Фармакопеї або чинного нормативного документа, після чого спрямовується на аналіз до територіальної контрольно-аналітичної лабораторії.
ІІ. Запобіжні заходи
1. Запобіжні заходи полягають у виконанні таких вимог:
a. Дотримання санітарних і правил; протиепідемічного режиму, а також умов асептичного виготовлення лікарських засобів відповідно до чинних нормативних документів.
b. Дотримання правил отримання, збирання та зберігання води очищеної води для ін'єкцій; своєчасне санітарне оброблення трубопроводу; контроль за своєчасним вилученням стерильних розчинів, води очищеної, води для ін'єкцій для випробування на стерильність відповідно до чинних вимог.
2. Збірники для води очищеної води для ін'єкцій повинні мати чіткий напис: «Вода очищена», «Вода для ін'єкцій». На збірнику води прикріплюється бирка із зазначенням дати її отримання, номера аналізу та підпису того, хто перевірив. При одночасному використанні кількох збірників вони повинні бути пронумеровані.
a. Забезпечення справності та точності приладів, апаратів та вагового господарства, регулярності їх перевірки.
b. Ретельний перегляд рецептів та вимог лікувальних організацій, що вступають в аптеку, з метою перевірки правильності їх виписування; сумісності речовин, що входять до складу лікарських засобів; відповідності прописаних доз віку хворого та наявності вказівок про способи застосування лікарських засобів.
с. Дотримання технології лікарських засобів (у тому числі гомеопатичних) відповідно до вимог діючої Державної Фармакопеї, нормативних документів, методичних вказівок.
d. Забезпечення в аптеці умов зберігання лікарських засобів відповідно до їх фізико-хімічними властивостямита вимогами Державної Фармакопеї, чинних нормативних документів.
i. У приміщеннях зберігання на всіх штангласах з лікарськими засобами мають бути зазначені: номер серії організації-виробника, номер аналізу контрольно-аналітичної лабораторії (центру контролю якості лікарських засобів), термін придатності, дата заповнення та підпис, що заповнив штанглас. На штангласах з лікарськими засобами, що містять серцеві глікозиди, має бути зазначено кількість одиниць дії в одному грамі лікарської рослинної сировини або в одному мілілітрі лікарського засобу.
ii. В асистентських кімнатах на всіх штангласах з лікарськими речовинами повинні бути зазначені: дата заповнення, підпис, що заповнив штанглас і перевірив справжність лікарської речовини. На штангласах з отруйними та сильнодіючими лікарськими речовинами мають бути зазначені вищі разові та добові дози, а на штангласах з лікарськими речовинами, призначеними для виготовлення стерильних лікарських форм, має бути попереджувальний напис «Для стерильних лікарських форм».
iii. Штангласи з розчинами, настойками та рідкими напівфабрикатами повинні бути забезпечені нормальними краплемерами або піпетками. Число крапель у певному обсязі має бути встановлене зважуванням та позначене на штангласі.
iv. Заповнення штангласу, бюретки у бюретковій установці, штангласу з нормальним каплемером або піпеткою повинно проводитися лише після повного використаннялікарського засобу та відповідної обробки штангласу.
e. Номенклатура концентратів, напівфабрикатів та внутрішньоаптечної заготівлі лікарських засобів, що виготовляються в аптеках, повинна затверджуватись територіальною контрольно-аналітичною лабораторією та доводитись до відома всіх аптек відповідної території. Цей перелік може включати лише прописи, що містять сумісні лікарські речовини, на які є методики аналізу для хімічного контролю*.
f. Керівникам аптеки необхідно один раз на квартал здійснювати контроль за дотриманням правил зберігання лікарських засобів у відділеннях лікувальних організацій, прикріплених до аптеки.
3. У відділеннях лікувальних організацій не допускається виготовлення лікарських засобів, розфасовка, переміщення з однієї ємності (упаковки) в іншу та заміна етикеток. Лікарські засоби повинні зберігатися у відділеннях тільки в оригінальній (заводській, фабричній або аптечній) упаковці.
4. Для контролю за терміном придатності на упаковці фасування, що відпускається аптекою у відділення лікувальної організації, має бути вказано серію організації-виробника.
5. Лікарські засоби з аптек до лікувальних організацій повинні відпускатися лише уповноваженому медичному персоналу.
ІІІ. Письмовий контроль
1. При виготовленні лікарських форм за рецептами та вимогами лікувальних організацій заповнюються паспорти письмового контролю. У паспорті повинні бути зазначені: дата виготовлення, номер рецепту (номер лікувальної організації, назва відділення), найменування взятих лікарських речовин та їх кількості, кількість доз, що підпису виготовив, розфасував та перевірив лікарську форму. У разі виготовлення лікарської форми практикантом ставиться підпис особи, відповідальної за виробничу практику.
2. Усі розрахунки повинні проводитися до виготовлення лікарської форми та записуватися на зворотній стороніпаспорти. Паспорт заповнюється негайно після виготовлення лікарської форми, з пам'яті, латинською мовою, відповідно до послідовності технологічних операцій. При заповненні паспорта на гомеопатичні лікарські формивказуються гомеопатичні назви послідовно взятих лікарських засобів.
3. У разі використання напівфабрикатів та концентратів у паспорті вказується їх склад, концентрація, взятий обсяг чи маса. При виготовленні порошків, супозиторіїв та пігулок вказується загальна маса, кількість та маса окремих доз. Загальна маса пігулок або супозиторіїв, концентрація та об'єм (або маса) ізотонуючої та стабілізуючої речовин, доданих у очні краплі, розчини для ін'єкцій та інфузій, мають бути зазначені не лише у паспортах, а й на рецептах.
4. У паспорті слід зазначати формули розрахунку та використані при цьому коефіцієнти водопоглинання для лікарської рослинної сировини, коефіцієнти збільшення обсягу розчинів при розчиненні лікарських речовин, коефіцієнти заміщення при виготовленні супозиторіїв.
5. Ведення паспортів письмового контролю також необхідне, якщо лікарські форми виготовляються та відпускаються однією і тією самою особою. І тут паспорт заповнюється у процесі виготовлення лікарської форми.
6. Паспорти письмового контролю зберігаються в аптеці протягом двох місяців з моменту виготовлення лікарського засобу.
7. Виготовлені лікарські засоби, рецепти та заповнені паспорти передаються на перевірку провізору, який виконує контрольні функції під час виготовлення та відпуску лікарських засобів (далі «провізор-технолог»). Контроль полягає у перевірці відповідності записів у паспорті письмового контролю пропису у рецепті, правильності проведених розрахунків. Якщо проведено повний хімічний контроль якості лікарського засобу провізором-аналітиком, то на паспорті проставляється номер аналізу та підпис провізора-аналітика.
8. При виготовленні концентратів, напівфабрикатів, внутрішньоаптечної заготівлі та фасування лікарських засобів усі записи проводяться в книгах обліку лабораторних та фасувальних робіт.
IV. Опитувальний контроль
1. Опитувальний контроль застосовується вибірково. Проводиться після виготовлення фармацевтом трохи більше п'яти лікарських форм.
2. При проведенні опитувального контролю провізор-технолог називає першу речовину, що входить у лікарську форму, а в лікарських формах складного складу вказує також її кількість, після чого фармацевт називає всі взяті лікарські речовини та їх кількості. При використанні напівфабрикатів (концентратів) фармацевт називає також їх склад та концентрацію.
1. У порядку виключення виготовлення ароматних вод, внутрішньоаптечної заготівлі лікарських засобів для зовнішнього застосування, що містять дьоготь, іхтіол, сірку, нафталанську нафту, колодій, свинцеву воду, а також гомеопатичних лікарських засобів, аналіз яких не може бути здійснений в умовах аптеки, проводиться під спостереженням провізора, зайнятого контролем якості лікарських засобів.
V. Органолептичний контроль
1. Органолептичний контроль полягає у перевірці лікарської форми (у тому числі гомеопатичної) за показниками: «Опис» (зовнішній вигляд, колір, запах), однорідність, відсутність видимих механічних включень (у рідких лікарських формах). На смак перевіряються вибірково лікарські форми, призначені для дітей.
2. Однорідність порошків, гомеопатичних тритурацій, мазей, пігулок, супозиторіїв перевіряється відповідно до вимог Державної Фармакопеї, чинних нормативних документів. Перевірка здійснюється вибірково у кожного фармацевта протягом робочого дня з урахуванням різних видівлікарських форм.
3. Результати органолептичного контролю лікарських форм реєструються в журналі за формою, що додається (Додаток 2 до цієї Інструкції).
VI. Фізичний контроль
1. Фізичний контроль полягає у перевірці загальної маси або обсягу лікарської форми, кількості та маси окремих доз (не менше трьох доз), що входять до цієї лікарської форми.
2. Перевіряються:
3. кожна серія фасування та внутрішньоаптечної заготівлі у кількості не менше трьох упаковок (у тому числі фасування промислової продукції та гомеопатичних лікарських засобів);
4. лікарські форми, виготовлені за індивідуальними рецептами (вимогами), вибірково протягом робочого дня з урахуванням різних видів лікарських форм, але не менше 3% кількості лікарських форм, виготовлених за день;
5. кожна серія лікарських форм, що вимагають стерилізації, після розфасовки до їхньої стерилізації у кількості не менше ніж п'ять флаконів (пляшок);
6. кількість гомеопатичних гранул у певній масі навішування відповідно до вимог чинних нормативних документів.
7. Результати фізичного контролюреєструються в журналі за формою, що додається (Додаток 2 до цієї Інструкції).
8. При перевірці лікарських форм контролюється також якість закупорювання.
VII. Хімічний контроль
1. Хімічний контроль полягає в оцінці якості виготовлення лікарського засобу за показниками: «Справжність», «Випробування на чистоту та допустимі межі домішок» (якісний аналіз) та «Кількісне визначення» (кількісний аналіз) лікарських речовин, що входять до його складу.
2. Якісному аналізу піддаються обов'язково:
3. Вода очищена, вода для ін'єкцій щодня (з кожного балона, а при подачі води трубопроводом на кожному робочому місці) на відсутність хлоридів, сульфатів та солей кальцію. Вода, призначена для виготовлення стерильних розчинів, крім зазначених вище випробувань, повинна бути перевірена на відсутність відновлювальних речовин, солей амонію та вуглецю діоксиду відповідно до вимог діючої Державної Фармакопеї. Щоквартально вода очищена повинна прямувати до територіальної контрольно-аналітичної лабораторії для повного хімічного аналізу.
4. Усі лікарські засоби, концентрати та напівфабрикати (у тому числі гомеопатичні настойки, тритурації, розчини, розведення), що надходять із приміщень зберігання в асистентську кімнату, а у разі сумніву – лікарські засоби, що надходять до аптеки зі складу.
5. Концентрати, напівфабрикати та рідкі лікарські засоби у бюретковій установці та у штангласах з піпетками в асистентській кімнаті при заповненні.
6. Лікарські засоби промислового виробництва, розфасовані в аптеці, та внутрішньоаптечна заготовка, виготовлена та розфасована в аптеці (кожна серія).*
7. . Якісного аналізу піддаються вибірково:
8. . Лікарські форми, виготовлені за індивідуальними рецептами та вимогами лікувальних організацій, у кожного фармацевта протягом робочого дня, але не менше ніж 10% від загальної кількості виготовлених лікарських форм. Перевірці повинні піддаватися різні види лікарських форм. Особлива увага звертається на лікарські форми: для дітей; що застосовуються в очній практиці; містять наркотичні та отруйні речовини.
9. Серія - певну кількістьоднорідного готового продукту (лікарського засобу), виготовленого за один виробничий цикл за постійних умов.
10. Якісному аналізу піддаються вибірково гомеопатичні розведення четвертого десяткового розведення, що містять отруйні та сильнодіючі біологічно активні речовиниабо отруйні та сильнодіючі неорганічні та органічні сполуки.
11. . Результати якісного аналізу реєструються в журналах за формами, що додаються (Додатки 2,3,4 до цієї Інструкції).
12. Якісному та кількісному аналізу (повний хімічний контроль) піддаються обов'язково:
13. . Всі розчини для ін'єкцій та інфузій до стерилізації, включаючи визначення величини рН, ізотонуючих та стабілізуючих речовин. Розчини для ін'єкцій та інфузій після стерилізації перевіряються на величину рН, справжність та кількісний вміст діючих речовин. Стабілізатори у цих розчинах після стерилізації перевіряються у випадках, передбачених чинними нормативними документами, зокрема методичними вказівками. Для контролю після стерилізації відбирається один флакон від кожної серії.
14. Стерильні розчини для зовнішнього застосування (офтальмологічні розчини для зрошень, розчини для лікування опікових поверхонь та відкритих ран, для інтравагінального введення та ін.).
15. Очні краплі та мазі, що містять наркотичні та отруйні речовини. При аналізі очних крапель вміст ізотонуючих і стабілізуючих речовин визначається до стерилізації.
16. Усі лікарські форми для немовлят*.
17. . Розчини атропіну сульфату та кислоти хлористоводневої (для внутрішнього вживання), розчини ртуті дихлориду та срібла нітрату.
18. . Усі концентрати, напівфабрикати, тритурації, у тому числі рідкі гомеопатичні розведення неорганічних та органічних лікарських речовин та їх тритурації до третього десяткового розведення**.
19. . Вся внутрішньоаптечна заготівля лікарських засобів (кожна серія).
20. Стабілізатори, які застосовуються при виготовленні розчинів для ін'єкцій та буферні розчини, що застосовуються при виготовленні очних крапель.
21. Концентрація спирту етилового при розведенні в аптеці, а у разі потреби - при прийомі зі складу.
22. Як виняток, виготовлення складних за складом лікарських форм для новонароджених дітей, які не мають методик якісного та кількісного аналізу, проводиться під наглядом провізора-аналітика або провізора-технолога.
23. Концентрація спирту етилового у водно-спиртових гомеопатичних розчинах, розведеннях та краплях (кожна серія).
24. Гомеопатичні гранули на розпадність (кожна серія) відповідно до вимог чинних нормативних документів.
25. Якісному та кількісному аналізу (повний хімічний контроль) піддаються вибірково:
26. Лікарські форми, виготовлені в аптеці за індивідуальними рецептами або вимогами лікувальних організацій, перевіряються у кількості не менше трьох лікарських форм під час роботи в одну зміну з урахуванням різних видів лікарських форм. Особлива увага звертається на лікарські форми для дітей: що застосовуються в очній практиці; містять наркотичні та отруйні речовини; розчини для лікувальних клізм.
27. Результати повного хімічного контролю реєструються в журналі за формою, що додається (Додаток 2 до цієї Інструкції). У журналі обов'язково реєструються усі випадки незадовільного виготовлення лікарських засобів.
