Système d'assurance qualité dans les organisations pharmaceutiques. Création d'un système de gestion de la qualité des médicaments en pharmacie
Recherche en texte intégral:
Accueil> Résumé> Médecine, santé
médicaments en pharmacie
Arrêté du ministère de la Santé de la Fédération de Russie n° 80 du 03/04/2003 "Sur l'approbation de la norme de l'industrie" Règles pour la libération (vente) de médicaments dans organisations de pharmacie... Dispositions de base". Contient la section IX Assurance qualité médicaments(médicaments) dans les organisations pharmaceutiques.
Les organisations pharmaceutiques ou les entrepreneurs individuels devraient avoir un système d'assurance qualité qui comprend :
des locaux et équipements correspondant au périmètre d'activités de l'établissement pharmaceutique et permettant d'assurer le respect des conditions de stockage et de fabrication des médicaments ;
une documentation qui vous permet d'identifier l'origine, la quantité et la qualité des médicaments entrants et de tenir des registres des médicaments stockés et vendus ;
contrôle entrant des médicaments arrivant à une organisation pharmaceutique ou à un entrepreneur individuel ;
personnel possédant les qualifications requises;
système de formation continue du personnel;
un fonds de documents réglementaires et de référence qui doit être fourni pour toutes les installations pharmaceutiques d'une organisation pharmaceutique donnée.
L'organisation pharmaceutique doit disposer d'un système de gestion de la qualité pour l'organisation pharmaceutique.
Chaque organisation pharmaceutique doit avoir un règlement interne du travail approuvé par le chef de l'organisation, avec une marque sur la familiarisation des employés. La révision des règles et la re-familiarisation avec celles-ci des employés de l'organisation de la pharmacie sont effectuées chaque année.
L'organisation de la pharmacie doit effectuer régulièrement des contrôles internes de conformité aux exigences de GOST. Lors des inspections, il convient de prêter attention à la disponibilité dans l'organisation de la pharmacie des documents pertinents pour les locaux occupés, des descriptions de poste des employés, des normes et des autres documents nécessaires.
Les inspections peuvent être effectuées à la fois par des employés de l'organisation pharmaceutique, indépendants des personnes exerçant directement l'activité inspectée, et par des experts indépendants. La fréquence des contrôles est déterminée par l'organisation pharmaceutique elle-même. Les résultats des inspections sont enregistrés et portés à la connaissance du personnel responsable de la zone de travail inspectée et de la direction de l'organisation de la pharmacie. Lors de contrôles ultérieurs, la mise en œuvre des recommandations et leur efficacité sont contrôlées. Chaque employé d'une organisation pharmaceutique doit connaître GOST, la procédure à suivre pour s'acquitter des tâches qui lui sont assignées, les actes juridiques réglementaires et les normes liées aux activités de l'organisation. Les organisations pharmaceutiques doivent avoir des descriptions de poste pour chaque employé, approuvées dans l'ordre approprié.
Les organisations pharmaceutiques doivent prévoir un système de développement professionnel continu des employés sur la législation en vigueur, l'utilisation des médicaments, etc. Le plan et les thèmes des cours sont approuvés par le chef de l'organisation pharmaceutique. Le responsable de l'organisation de la pharmacie désigne un représentant qualité parmi le personnel de gestion.
À cet égard, il n'y a aucun doute sur la nécessité d'une amélioration continue des compétences professionnelles du personnel pharmaceutique. L'un des moyens de résoudre ce problème est d'augmenter l'efficacité du système de formation postuniversitaire des pharmaciens.
L'organisation de la pharmacie assure la tenue de la documentation conformément aux actes juridiques législatifs et réglementaires Fédération Russe.
Tout d'abord, la tâche de la pharmacie est de fournir les caractéristiques préservées des marchandises reçues par l'organisation de la pharmacie. Il s'agit de deux groupes : les qualités fonctionnelles - efficacité et sécurité, physiques et physico-chimiques, nécessitant le respect des règles de manipulation. Dans le cadre du système de gestion de la qualité d'une organisation pharmaceutique, chaque pharmacie doit organiser :
1. Contrôle de réception... Elle est effectuée afin d'empêcher la réception et la vente de produits contrefaits, rejetés et de qualité inférieure à travers le réseau de pharmacies. Il est réglementé par la norme industrielle OST 91500.05.0007.-2003 « Règles pour la délivrance (vente) de médicaments dans les organisations pharmaceutiques ». Les zones (locaux) de réception et de distribution des médicaments doivent être séparées de la zone de stockage et doivent assurer une protection adéquate (fiable) des médicaments reçus contre les intempéries pendant les opérations de chargement (déchargement). Les produits qui en résultent sont soumis à un contrôle qualité entrant. Les résultats du contrôle entrant doivent être enregistrés conformément à l'établi dans la pharmacie commande interne... Pendant déchargement des produits vérifier sa conformité à la commande et l'absence d'endommagement des colis ou conteneurs. Les médicaments et autres produits approuvés à la vente par des organisations pharmaceutiques dont la durée de conservation est expirée, ne répondant pas aux exigences de qualité, aux normes et sans documents certifiant leur qualité ne sont pas soumis à acceptation. Pour les médicaments (médicaments) dans des emballages endommagés ne disposant pas des certificats et/ou des documents d'accompagnement nécessaires, refusés lors de la réception ou de la délivrance au patient, ne correspondant pas à la commande ou ayant une durée de conservation expirée, un acte est établi ; ils doivent être étiquetés de manière appropriée et placés dans une zone désignée séparée des autres médicaments jusqu'à ce qu'ils soient identifiés, renvoyés au fournisseur ou détruits conformément à la procédure établie. Substances toxiques et puissantes stupéfiants, substances psychotropes, médicaments thermolabiles doivent être immédiatement placés dans des zones de stockage conformément aux exigences du présent OCTa.
Le nombre de médicaments pris nécessitant des conditions de stockage particulières doit correspondre à la capacité disponible des équipements spéciaux. Les médicaments acceptés et autres produits autorisés à être délivrés par les organisations pharmaceutiques sont crédités dans le délai imparti pour l'acceptation des produits par le nombre d'unités de produits et l'intégralité de la manière prescrite. 6. Toute livraison de la marchandise doit être accompagnée de documents permettant d'établir la date d'expédition, le nom du médicament (y compris la forme galénique et la posologie), le lot et le numéro de lot, la quantité de la marchandise livrée, le prix du médicament délivré, le nom et l'adresse du fournisseur et du destinataire, ainsi que les documents attestant de la qualité des médicaments. Les documents confirmant la qualité des médicaments sont une déclaration de conformité ou un certificat de conformité Un indicateur important est-ce que la pharmacie ou chaîne de pharmacies travailler avec un lien de gros fiable, des sociétés multinationales bien connues, qui ont leur propre "service de sécurité des médicaments" défini très au sérieux.
Le contrôle d'acceptation, ainsi que la vérification de l'exactitude des documents, comprend la vérification des médicaments selon les indicateurs "Description", "Emballage", "Marquage", qui est déterminé par les exigences de l'arrêté du ministère de la Santé de la Fédération de Russie du 07.16. .97. N° 214 "Sur le contrôle de la qualité des médicaments fabriqués dans les organisations pharmaceutiques (pharmacies)". Le contrôle selon l'indicateur "Description" comprend la vérification de l'apparence, de la couleur, de l'odeur. L'incohérence de la couleur, la présence d'odeur étrangère, les sédiments, les flocons, les impuretés mécaniques, le gel, la stratification sont des motifs de rejet. En cas de doute sur la qualité des médicaments, des échantillons sont envoyés au centre territorial de contrôle qualité des médicaments. Ces médicaments portant la mention : « Rejeté lors du contrôle de réception » sont stockés dans la pharmacie séparément des autres médicaments. Le contrôle selon l'indicateur « Emballage » comprend la vérification de l'intégrité de l'emballage, la présence d'un emballage secondaire et la conformité de l'emballage avec les propriétés physico-chimiques des médicaments.
2. Locaux et équipements. Exigences de base pour l'organisation du stockage des médicaments et des produits but médical en officine instituée par l'Instruction d'organisation du stockage en officine différents groupes médicaments et fournitures médicales. Les médicaments nécessitant des conditions de conservation particulières doivent être immédiatement identifiés et placés dans des salles de stockage (zones) selon les exigences de la législation en vigueur. La salle de stockage de la pharmacie doit être suffisamment grande pour permettre le stockage ordonné des différentes catégories de matériaux et de produits. Propre et sécurisé. Médicaments en production entrepôts doivent être stockés sur des racks, des palettes, des podtovariye, dans des armoires, des réfrigérateurs et autres équipement spécial assurer des conditions de conservation des médicaments conformes aux exigences en vigueur . S'il y a des préparations immunobiologiques dans la base de la pharmacie (entrepôt), le volume total des équipements de réfrigération doit assurer, conformément aux exigences en vigueur, le stockage de la totalité de ces médicaments, qui est contenue dans la base (entrepôt). Lors du stockage de médicaments, le titulaire de l'autorisation est tenu d'exclure leurs dommages (renversement, renversement, bris), la contamination par des micro-organismes et la contamination croisée. Le stockage des médicaments nécessite des conditions de température particulières, contrôlées par des dispositifs de surveillance à température constante ou des conteneurs thermiques.
3... Personnel... Un troisième principe de gestion s'applique aux ressources : l'implication des salariés. Ce sont les employés de tous les niveaux qui forment l'épine dorsale de l'organisation. Leur pleine implication permet à l'organisation de bénéficier de leurs capacités. D'une part, la décision de gestion que le système de gestion doit fonctionner, et d'autre part, seulement lorsque l'ensemble du personnel se rend compte que le système de gestion n'est pas une simple collection de feuilles de papier supplémentaires qui seront sur l'étagère. Ce doit être une structure efficace, et cela ne fonctionnera que lorsque tout le monde comprendra sur quoi elle est basée et pourquoi elle est faite. Dans chaque pharmacie, sous une forme ou une autre, un système de gestion de la qualité a été créé et fonctionne avec succès - pour certains, il est de 10 %, pour certains, il est de 90 %.
4. Documentation Les opérations affectant la qualité des marchandises doivent être décrites dans des procédures écrites. Le système de gestion de la qualité vise à systématiser les processus, à voir si tous sont dotés des ressources et des documents nécessaires. Il est important de savoir si tous les processus ont des procédures et des règles documentées pour leur mise en œuvre. Le processus de révision et d'amélioration est nécessaire pour prendre des décisions de gestion factuelles - c'est le septième principe de gestion des normes ISO. Des solutions efficaces sont basées sur l'analyse des données et des informations.
7. Remboursements... La présence de médicaments de qualité inférieure ou falsifiés en circulation, à l'exclusion de ceux dont la durée de conservation est dépassée, n'est pas autorisée. Après avoir identifié le fait de la présence de médicaments de qualité inférieure, contrefaits et similaires, l'entité commerciale doit rédiger un acte approprié et prendre des mesures pour les exclure de la circulation. L'exclusion de ces médicaments de la circulation se fait par élimination et destruction conformément aux règles d'élimination des médicaments. Une procédure de travail avec les lettres de Roszdravnador sur les produits rejetés et falsifiés pour les spécialistes du Centre a été développée conformément aux exigences et sous les formes spécifiées dans la lettre Service fédéral sur la surveillance dans le domaine des soins de santé et développement social du 28.09.2004. n° 4082/04.
5. Optimisation du système de management de la qualité activités pharmaceutiques en pharmacie
À la suite de l'étude de la littérature sur la gestion de la qualité PL, il est possible de proposer d'optimiser les activités des organisations pharmaceutiques en introduisant les principes suivants :
La qualité de gestion est un concept à multiples facettes, elle comprend de nombreuses composantes, telles que : la transparence et la contrôlabilité des processus, la qualité de l'information, la possibilité de contrôle opérationnel des activités en cours, et bien plus encore. Parallèlement, divers documents sont pratiquement le seul outil de mise en œuvre de la gestion. Ainsi, le moyen évident de changer la qualité de la gestion d'entreprise est d'améliorer l'efficacité du travail avec les documents.
La gestion de la qualité en pharmacie repose sur principes suivants:
Assortiment et volume suffisants de prix abordables LS
La tâche de la pharmacie n'est rien de plus que de fournir à la population des médicaments et produits de pharmacie v le bon endroit et à un moment opportun pour les visiteurs, pour lesquels les besoins, un fournisseur sont déterminés, une demande est établie, un achat est effectué, et le dosage est étudié.
Accessibilité sociale
Recherche sur l'assortiment dans les synonymes et les analogues. La pharmacie contient plus d'un nom commercial d'une substance active. Les noms commerciaux varient parfois de 100 à 700%, selon le fabricant. La pharmacie achète différentes marques à différents niveaux pour assurer l'inclusion sociale de différents groupes sociaux visiteurs. Dans un groupe pharmacothérapeutique, vous pouvez prendre à la fois des médicaments coûteux et des médicaments à coût moyen et faible.
Accompagnement information et conseil
Les pharmaciens doivent anticiper les attentes des consommateurs et s'assurer que le produit répond à ces attentes. Ce n'est pas toujours possible. Par exemple, un consommateur souhaite consulter un pharmacien avant d'acheter un médicament. Mais un pharmacien n'est pas un médecin et n'a aucune responsabilité légale pour la santé du patient dans notre pays. Cependant, n'obtenant pas ce qui était attendu, le consommateur reste insatisfait.
Mise en place de systèmes informatiques en officine et utilisation des codes-barres dans le contrôle qualité des médicaments en officine
Le système d'automatisation de pharmacie diffère des systèmes d'automatisation de vente au détail. Les pharmacies ont beaucoup de spécificités propres, principalement liées à la tarification, qui en Russie a toujours été un processus complexe et déroutant. La tarification en pharmacie s'effectue selon certains documents législatifs et est strictement réglementée ; il existe une liste de médicaments qui ne sont pas taxés. Le prix de détail est formé différemment pour ces médicaments. Auparavant, le processus de réception des marchandises et d'enregistrement des prix pour les employés de la pharmacie était laborieux et prenait du temps. Par conséquent, l'automatisation est tout simplement indispensable ici.
Les systèmes d'automatisation permettent aux pharmaciens d'afficher des données sur ce qui est en stock, quels médicaments sont épuisés et ce qui doit être acheté. Le processus de visualisation rapide des soldes réels est l'un des plus importants lors du choix d'un système d'automatisation.
Dans toute pharmacie ordinaire, où il y a une simple caisse enregistreuse, lors d'un achat, l'argent que nous payons au caissier n'est en aucun cas directement lié aux marchandises que nous recevons.
Et ici plusieurs problèmes se posent à la fois :
Premièrement, la pharmacie manque d'une comptabilité complète et détaillée des mouvements de biens et de fonds. Il est impossible, par exemple, de dire à un moment donné quelle quantité d'un produit donné a été vendue, laissée en parquet ou dans un entrepôt, il est impossible d'interdire automatiquement le poinçonnage de marchandises déjà terminées, etc. ;
Deuxièmement, il est difficile d'éviter les erreurs que le caissier peut commettre ;
Troisièmement, l'absence d'une comptabilité détaillée ne permet pas de réaliser des statistiques et une analyse détaillée de la dynamique des ventes, ce qui rend difficile une réponse plus souple aux évolutions de la demande.
6. Analyse et moyens d'améliorer le système de gestion de la qualité des médicaments dans la pharmacie de la SARL "MAIR"
MAIR LLC opère sur le marché pharmaceutique depuis plus de 15 ans dans le territoire de Primorsky. Son réseau de pharmacies regroupe 5 points de vente et est très populaire - plusieurs milliers d'habitants de Vladivostok ont des cartes clients réguliers... Occupe le deuxième étage d'un immeuble de 2 étages. Le local de la pharmacie est neuf, fonctionne depuis mai 2010, répond à toutes les exigences des MTN et des normes sanitaires, fonctionne de 9h00 à 20h00 sept jours sur sept. Il y a des panneaux indiquant le nom de la pharmacie et les heures d'ouverture. Situé dans un endroit pratique pour les visiteurs, près de l'arrêt de bus.
Mair considère que sa mission principale n'est pas tant la vente de médicaments, la vente de produits pharmaceutiques et de médicaments, les produits médicaux, mais la fourniture de services pharmaceutiques pour haut niveau, par conséquent, la société s'efforce d'être orientée client, de garantir la qualité des médicaments et de servir au mieux l'acheteur. Tout cela, associé à un désir compréhensible de rendre leur travail plus efficace, a amené la direction à réfléchir à la mise en place d'un système de gestion de la qualité.
Ayant travaillé sur un système de gestion de la qualité pendant moins d'un an, une pharmacie peut tirer quelques conclusions. Des indicateurs objectifs confirment que la mise en place d'un système de management de la qualité a contribué à l'optimisation du fonds de roulement : le volume des ventes dans les pharmacies de la chaîne a augmenté, le nombre de produits à faible revenu et illiquides, ainsi que de produits périmés, a diminué. Le nombre de clients réguliers a augmenté. L'analyse de leur demande, souhaits et offres a permis de pratiquement se débarrasser des défauts. De plus, en raison de l'orientation du personnel vers le travail avec les clients, non seulement le nombre d'achats en ligne a considérablement augmenté, mais ils ont également été optimisés. coût moyen... Les spécialistes de la gestion de la qualité soulignent actuellement que le lien principal et le plus problématique dans toute structure de gestion est l'humain. Dans notre cas, il s'agit de pharmaciens spécialisés. Ceux qui sont en contact direct avec les clients, les visiteurs, les consommateurs. Pour la mise en place du système de gestion de la qualité en pharmacie, quelques changements ont été apportés dans la structure organisationnelle et dans les relations au sein de l'équipe. Un système efficace de formation du personnel, un suivi constant de la formation ont augmenté la qualité du travail du personnel.
À la suite de l'analyse des données de la littérature étrangère et nationale, il a été constaté que les problèmes du système de gestion de la qualité des médicaments dans les institutions pharmacologiques en Russie et à l'étranger sont donnés grande attention... Lors de l'étude des concepts de base dans la construction de modèles et le fonctionnement des systèmes de gestion de la qualité, un leadership clair est démontré par des approches basées sur le concept de gestion de la qualité totale (TQM) et les normes de la série ISO 9000, qui prévoient un certain nombre de principes généraux: orientation client, leadership managérial, approche processeur, approche système, amélioration continue, relations fournisseurs mutuellement bénéfiques, etc.
Le système de gestion de la qualité dans le domaine de la circulation des médicaments en Russie est déterminé par la loi fédérale n° 86 sur les médicaments. La gestion de la qualité des organisations pharmaceutiques est basée sur les principes de la TQM et de la série et des normes ISO 9000. normes de l'industrie : OST91500.05.005-2002 "Règles pour le commerce de gros des médicaments. Dispositions de base", approuvées par arrêté du ministère de la Santé de la Fédération de Russie du 15/03/2002 n° 80 ; OST 91500.05.0007-2003.
Conformément à la pratique internationale, la pharmacie est entièrement responsable de la qualité des produits achetés auprès des fournisseurs, seules les exigences obligatoires pour les produits sont déterminées par la loi et toutes les autres conditions sont stipulées dans un accord entre les acteurs du marché.
Le système de gestion de la qualité dans le domaine de la circulation des médicaments doit être fiable, préventif, empêchant la fourniture de services pharmaceutiques de qualité inférieure au consommateur, ainsi que personnalisé, c'est-à-dire avoir des personnes spécifiques responsables de cela.
On considère certains principes permettant d'optimiser le système de management de la qualité dans le domaine de la circulation du médicament en officine.L'étude de la littérature sur le management de la qualité du médicament peut être proposée pour optimiser les activités des organisations officinales en introduisant les principes suivants.
BIBLIOGRAPHIE
Arrêté du ministère de la Santé de la Fédération de Russie du 03/04/2003. N° 80 « Sur l'approbation de la norme de l'industrie » Règles pour la distribution (vente) de médicaments dans les organisations pharmaceutiques. Dispositions de base".
Skulkova R.S., Yagudina R.I., Parkhomenko D.V. Formation d'un système de gestion de la qualité pour les organisations pharmaceutiques. Nouvelle pharmacie. Règlements. 2005.-N 4.-С.32-37 .
I.G. Komissinskaya Concept moderne gestion de la qualité d'une organisation pharmaceutique // pharmacies de Moscou. - 2007. - N° 11.
Alferova, T.V. Gestion de la production dans les entreprises pharmaceutiques / T.V. Alferova, E.A. Tretiakov, A.V. Builin. - Ekaterinbourg : Maison d'édition de l'Institut d'économie de la branche ouralienne de l'Académie des sciences de Russie, 2008. - 214p.
Moskvin V.A. Évolution dans le domaine de la gestion de la qualité / V.A. Moskvin // Investissements en Russie 2004. N° 5.- S. 27-28.
Lagutkina T.P. N.-É. principes de gestion de la qualité dans les activités d'une organisation pharmaceutique // Bulletin de l'Université de l'Amitié des Peuples de Russie. 2008.-N 4.-С.36-39.
Polesskiy V.A. Évolution des modèles de système qualité : pratique internationale / V.A. Polesskiy, S.A. Martynchik, V.G. Zaporozhchenko, V.Z. Kucherenko // Économie de la santé. - 2005. - N° 8. - Art. 25-36.
la loi fédérale"Sur les Médicaments" n° 86-FZ du 22.06.98
Drugova Z.K., Biteryakova A.M. Système de contrôle interne et qualité de gestion // Pharmacies russes. - N°2. - 2007.
Koonova S.V. Le système d'assurance qualité des services pharmaceutiques dans le complexe pharmaceutique régional : Monographie. - Nijni Novgorod: Maison d'édition VGIPA, 2003.
Conditions de conservation des médicaments. - M. : Médecine, 2006.-- 184p.
Kulaev V.A., Egorov V.A., Gladunova E.P., Ezhkov V.N. Système intégré de gestion de la qualité des soins pharmaceutiques // Pharmacie, 2011, n° 3, pp. 30-33
GOU VPO " PERM STATE PHARMACEUTICAL ACADEMY "
Département de gestion et d'économie de la pharmacie FDPO et FZO
Cours de remise à niveau pour les cours par correspondance
utilisant les technologies à distance dans la spécialité "Gestion et Economie de la Pharmacie"
Durée de la formation (du 15.10.2010 au 14.09.2011)
Travail de cours sur ce sujet:
“Création d'un système de gestion de la qualité des médicaments en pharmacie ”
EXÉCUTEUR:
Fadeeva Maria Valerievna, pharmacienne stagiaire
Base de recherche :
Pharmacie "MAIR"
Ville de Vladivostok
Perm 2011
introduction
1. État de l'art systèmes de gestion de la qualité des médicaments dans les activités de pharmacie en pays étrangers…………....……5
2. Le cadre législatif gestion de la qualité des médicaments dans les organisations officinales selon la littérature et les documents réglementaires …………………………………………………………… ..… ..10
3. Gestion pharmaceutique en officine ....................... 12
4. Création d'un système de gestion de la qualité des médicaments en pharmacie ………………………………………………………………………………………………………………… ……………… ..... 17
5. Optimisation du système de management de la qualité des activités pharmaceutiques en officine ....................... 22
6. Analyse et pistes d'amélioration du système de gestion de la qualité des médicaments dans la pharmacie de la SARL « MAIR » ………………… ... …… 23
Conclusion ……………………………………………………………………………… ..… 25
Liste de la littérature utilisée ………………………………………… ..26
INTRODUCTION
L'orientation sociale du marché pharmaceutique, qui fournit le besoin de médicaments vitaux, et, par conséquent, la nécessité de maintenir et d'améliorer la santé, nécessite le développement d'un système de gestion de la qualité des produits et services pharmaceutiques introduits sur le marché. La base de ce système est le système de gestion de la qualité des médicaments à toutes les étapes de leur cycle de la vie et la qualité des soins pharmaceutiques en tant qu'activité de prestation de services pharmaceutiques à la population. La qualité des médicaments au niveau fédéral est définie par la loi comme la conformité à la norme de l'État.
Le fonctionnement actuel du marché pharmaceutique russe se caractérise par une gamme de médicaments (MP) en constante expansion et un nombre déraisonnablement élevé de fournisseurs. Dans ces conditions, le problème d'assurer la qualité des soins médicaux prodigués à la population revêt une importance particulière. Conformément aux exigences de la norme actuelle de l'industrie « Règles pour la délivrance (vente) de médicaments dans les organisations pharmaceutiques. Dispositions de base « un système de gestion de la qualité devrait être créé dans chaque organisation pharmaceutique qui effectue la vente au détail de médicaments. Cela est dû à la responsabilité professionnelle particulière de la qualité des soins médicamenteux confiée aux pharmacies. Il y a aujourd'hui toute la ligne publications dans les principales publications pharmaceutiques, divers secteurs de l'économie, mais, malheureusement, en pharmacie, la gestion de la qualité et les activités d'un commissaire à la qualité se confondent avec l'exercice des fonctions fonctionnelles d'un pharmacien-analyste.
Si le système de gestion de la qualité est introduit depuis longtemps dans l'industrie, alors dans les activités d'une organisation pharmaceutique, il commence tout juste à vivre et à fonctionner. Jusqu'à présent, il n'y a pas de recommandations (documentées) pour la mise en œuvre du système dans les organisations pharmaceutiques, qui devrait être construite sur la base de normes internationales qualité.
Le concept de qualité est formé de la relation entre le fabricant et le consommateur du produit. Les produits sont de si haute qualité qu'ils satisfont les demandes et les besoins du consommateur. Les principales propriétés de la qualité sont les suivantes : inaliénabilité de l'objet (si l'on parle d'un réseau de distribution, alors la qualité doit être présente en tout point) ; incohérence dans le temps, il est impossible de mesurer la qualité une fois, car les facteurs d'influence changent et la qualité change en conséquence (par exemple, du nouveau personnel est arrivé, la charge sur lui a augmenté et, par conséquent, la qualité a changé). La formule de qualité peut s'exprimer comme suit : le rapport des caractéristiques perçues des services aux caractéristiques des services attendus par le client. La qualité est maximale si son indicateur est égal à un.
La mise en place d'un système de management de la qualité des activités pharmaceutiques conforme aux exigences internationales permet de s'éloigner de l'agrément des activités pharmaceutiques. Il est plus important de licencier un spécialiste. S'il y a des violations dans les activités que le spécialiste exerce, il est privé de sa licence et l'entreprise continue de fonctionner.
Outre, scène moderne Le développement du marché pharmaceutique russe se caractérise par une croissance en avalanche de la gamme de médicaments introduits sur le marché pour la première fois. Ceci, d'une part, permet au médecin, à condition qu'il y ait une connaissance professionnelle suffisante de la disponibilité des propositions et des propriétés des médicaments, de choisir le schéma pharmacothérapeutique optimal pour la maladie, d'autre part, cela complique la procédure de sélection elle-même en raison de aux nombreux critères de choix du médicament optimal. Le pharmacien impliqué dans la vente de médicaments, lorsqu'il conseille les consommateurs, rencontre aussi souvent certaines difficultés dues à une information insuffisante sur les caractéristiques pharmaco-économiques des nouveaux médicaments. Pour qu'un spécialiste réponde normes modernes et les exigences, il est nécessaire de définir clairement le degré de sa responsabilité pour le cas assigné. Exactement niveau professionnel spécialiste devrait devenir l'un des principaux éléments du système de gestion de la qualité dans une pharmacie.
Par conséquent, le but de ce travail est d'étudier des approches théoriques et pratiques pour créer un système de gestion de la qualité des médicaments dans une pharmacie, ainsi que d'analyser les problèmes qui se posent dans ce cas et de développer des moyens de les résoudre.
La mise en œuvre de cet objectif nécessite la résolution des tâches suivantes :
1. Étude de l'état actuel du système de gestion de la qualité des médicaments dans les activités de pharmacie à l'étranger et en Fédération de Russie
2. Considération fondements théoriques systèmes de gestion de la qualité des médicaments dans les organisations pharmaceutiques selon la littérature et les documents réglementaires.
3. Optimisation du système de management de la qualité des activités pharmaceutiques en officine.
4. Analyse de la gestion de la qualité des médicaments dans la pharmacie « MAIR » à Vladivostok.
La méthodologie de recherche est basée sur les principes constitutionnels des garanties étatiques de la protection de la santé des citoyens, les actes législatifs et réglementaires de la Fédération de Russie dans le domaine des soins de santé et approvisionnement en médicaments, le concept de politique nationale de l'OMS dans le domaine de l'approvisionnement en médicaments, les travaux scientifiques d'auteurs nationaux et étrangers dans le domaine de la gestion et de l'économie de la pharmacie et des soins de santé et de la gestion pharmaceutique. Pour rédiger l'ouvrage, de la littérature pédagogique sur la discipline, des articles de revues spécialisées, ainsi que des sources Internet ont également été utilisés.
1. L'état actuel du système de gestion de la qualité du médicament dans les activités de pharmacie à l'étranger
Lors de l'élaboration de sa propre politique nationale dans le domaine de l'approvisionnement en médicaments, la Russie devrait tenir compte autant que possible des exigences internationales acceptées. L'instruction spéciale du président de la Russie V.V. Poutine, donnée en septembre 2003, souligne la nécessité d'harmoniser les actes réglementaires de la Fédération de Russie dans le domaine de la circulation des drogues avec les normes internationalement acceptées. Dans la loi principale de 1998 et plus tard en 2003 dans la norme de l'industrie 80, des concepts tels qu'une pharmacie (y compris un hôpital), une pharmacie d'un établissement de santé, une pharmacie, une pharmacie, un kiosque de pharmacie étaient appelés « établissements pharmaceutiques ”. En fait, il existe aujourd'hui deux types d'organisations pharmaceutiques sur le marché pharmaceutique - les pharmacies associées à la vente au détail et les autres - les grossistes en médicaments.
I.G. Komissinskaya (2007) a examiné en détail le concept moderne de gestion de la qualité d'une organisation pharmaceutique dans le monde. L'ISO (ISO) - Organisation internationale de normalisation est une organisation internationale qui aide à l'élaboration de normes, de règles et d'autres documents similaires universellement reconnus afin de faciliter l'échange international de biens et de services. ISO est l'abréviation du mot grec isos, qui signifie « universel ». Il est important de comprendre ce que sont les normes ISO, pourquoi exactement elles régulent les exigences dans le monde entier, donnent des dispositions et des concepts de base dans le domaine des systèmes de gestion de la qualité.
L'histoire de l'émergence des normes ISO 9000 est associée à l'adoption dans l'UE du concept global d'assurance juridique de la qualité des biens et services, qui comprend : un système de gestion de la qualité du fabricant ; contrôle des produits dans les laboratoires d'essais; certification du produit; application du système de gestion de la qualité dans les organisations comme garantie de la qualité stable des produits et services.
L'expérience mondiale dans l'organisation du travail dans le domaine de la gestion de la qualité est résumée et systématisée dans la série ISO 9000 - il s'agit d'un ensemble de documents sur l'assurance qualité préparé par le 176e comité de l'Organisation internationale de normalisation.
Conformément à la pratique internationale, seules les exigences obligatoires pour les produits sont déterminées par la loi, et toutes les autres conditions sont stipulées dans un accord entre les acteurs du marché, c'est-à-dire. la pharmacie est entièrement responsable de la qualité des produits achetés auprès des fournisseurs. La série ISO 9000 est la référence internationale en matière d'exigences de qualité pour les entreprises. Leur objectif principal est d'aider les pharmacies à identifier les fournisseurs potentiels avec un système de gestion de la qualité efficace ; réduction des coûts de qualité grâce à la confiance dans la qualité du fournisseur ; assistance et assistance méthodologique aux organisations dans la création de systèmes qualité. Les principales sont : ISO 9000-2001, qui s'appelle « Système de gestion de la qualité ». Principes fondamentaux et vocabulaire « est une norme fondamentale à partir de laquelle toute la terminologie et tous les concepts sont basés. Sa suite logique est GOST R ISO 9001-2001, qui est appelé « Système de gestion de la qualité. Conditions". Aujourd'hui, dans la pratique mondiale, il existe plus de 20 normes ISO.
La qualité des médicaments s'entend comme leur conformité à toutes les conditions d'enregistrement, conditions de production (technologie, site de production, personnel) et caractéristiques spécifiées. Les produits pharmaceutiques, comme tout autre produit, passent par différentes étapes du cycle de vie (boucles de qualité) (Fig. 1).
Riz. 1. Le système d'assurance qualité des médicaments
La tendance mondiale actuelle dans le domaine du rationnement et de la réglementation de la production de médicaments est l'harmonisation mondiale des exigences de production de médicaments tout au long du cycle de vie d'un médicament et l'accent mis sur la satisfaction du consommateur conformément à l'utilisation prévue du médicament (Fig. 2 ).
Lorsqu'un médicament arrive sur le marché en provenance d'une entreprise, celle-ci reçoit un certificat de qualité signé par Personne autorisée fabricant s'il répond aux indicateurs de qualité du dossier d'enregistrement pour la sécurité, l'efficacité et est produit conformément aux règles GMP.
Dans le même temps, il existe deux domaines clairement exprimés - la responsabilité sociale croissante du fabricant de médicaments, imposée par l'État et la société dans son ensemble, et l'accent mis sur la garantie de la production de produits. bonne qualité par des mesures organisationnelles et managériales à toutes les étapes - du développement d'un nouveau médicament à la mise en œuvre produit fini- avec un rôle régulateur actif des organes de l'État.

Riz. 2. Exigences de base de l'OMS pour la qualité des médicaments
Le résultat des travaux du comité exécutif sur ce moment l'élaboration et l'adoption des documents relatifs au processus de création des médicaments (Q8 « Développement pharmaceutique »), à la gestion du risque qualité (Q9 « Gestion du risque qualité ») et au système qualité (Q10 « Systèmes de qualité pharmaceutique ») (Fig. 3).
De plus, du point de vue des normes ISO, nous examinerons ce que fait une organisation pharmaceutique, qui s'intéresse à quoi et comment rendre cette activité plus efficace et efficiente. Le concept d'assurance qualité des médicaments offre l'opportunité d'approfondir la compréhension, la prise de conscience et le respect des obligations incombant à tous les pharmaciens en exercice. Les bonnes pratiques pharmaceutiques (BPP) sont une activité liée à la fourniture, au stockage et à l'utilisation de médicaments et de dispositifs médicaux réalisée en pharmacie.
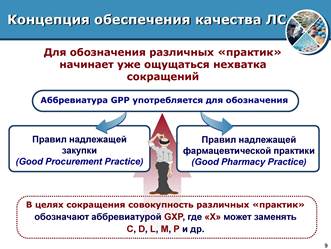
Figure 3. Règles de bonnes pratiques pharmaceutiques pour l'assurance qualité des médicaments
L'élaboration des règles est initiée par les autorités réglementaires nationales en étroite coopération avec les fabricants représentés par les associations pharmaceutiques.
La norme ISO et le certificat sont deux concepts indissociables. Bien sûr, vous pouvez mettre en œuvre un système ISO sans le certifier, mais qui peut vérifier à quel point il est bien construit ? V dans ce cas il existe un document appelé "Certificat ISO 9000", qui confirme la conformité du système de gestion de la qualité de l'organisation avec les exigences établies. Un certificat de médicament est un document qui confirme la conformité d'un médicament avec la qualité. Un certificat ISO est un document qui confirme la conformité du système de gestion de la qualité aux exigences imposées par les GOST correspondants. En parlant de système de gestion de la qualité, on ne peut que parler des normes ISO.
Les principales dispositions du système de management de la qualité sont décrites dans la norme ISO 9000. Elle formule 8 principes de management de la qualité :
1. Orientation client : comprendre ses besoins actuels et futurs, répondre à ses exigences et s'efforcer de dépasser ses attentes.
2. Leadership du leader, assurant l'unité de but et la direction de l'organisation.
3. Implication des travailleurs, permettant d'utiliser avec profit leurs capacités.
4. Une approche par processus pour gérer les activités et les ressources associées.
5. Approche systémique de la gestion : identifier, comprendre et gérer les processus interdépendants en tant que système contribue à l'efficacité et à l'efficience de l'organisation dans la réalisation de ses objectifs.
6. Amélioration continue des activités de l'organisation.
7. Prendre des décisions basées sur l'analyse des données et des informations.
8. Relations avec les fournisseurs mutuellement avantageuses.
L'atteinte des objectifs de qualité peut avoir un impact positif sur la qualité des produits, l'efficacité opérationnelle et la performance financière, et donc sur la satisfaction et la confiance des parties intéressées.
Les principales dispositions du système de management de la qualité comprennent la documentation, qui permet de transmettre le sens et l'enchaînement des actions.
Actuellement, il n'est plus envisagé de fournir seul qualité du produit, mais livré but la satisfaction des clients en remplissant et en dépassant leurs exigences grâce à la mise en œuvre de systèmes de gestion de la qualité efficaces, à l'amélioration continue de son efficacité, ainsi qu'à la prévention des écarts entre les attentes des clients et la qualité des produits et services qui leur sont proposés.
Le modèle le plus méthodologiquement solide, efficace et populaire est actuellement reconnu comme le modèle de gestion de la qualité totale (TQM), qui repose sur la mise en œuvre de principes tels que : orientation client, leadership des leaders, implication de tout le personnel dans la résolution des problèmes de qualité, approche processusà la gestion, l'amélioration continue de la production, la coopération mutuellement bénéfique, la prise de décision basée sur des faits.
2. Cadre législatif gestion de la qualité des médicaments dans les organisations officinales selon la littérature et les documents réglementaires
Il est important de considérer quelles normes fondamentales existent en Russie, lesquelles d'entre elles fournissent un décodage des concepts et définitions de base, quelle norme impose des exigences au processus de certification d'une organisation et au système de gestion de la qualité. De la Russie participe aux activités de l'ISO organisme gouvernemental- Gosstandart de Russie.
Dans le cadre de l'intégration dans la communauté mondiale, un ensemble de normes ISO est pris en compte et mis en œuvre en Russie, où, sur la base de ces normes, les éléments suivants ont été développés :
GOST R ISO 9000-2001, décrit les principales dispositions et contient la terminologie relative au système de gestion de la qualité.
GOST R ISO 9001-2001, définit les exigences pour le système de gestion de la qualité
La norme (GOST R ISO 9004-2001) est appelée « Système de gestion de la qualité. Recommandations pour améliorer les performances". Les normes 9001 et 9004 ont une structure complètement identique, mais la norme 9001 est plus claire et plus concise. La norme 9004 est, pour ainsi dire, basée sur la norme 9001, contient les mêmes sections, mais sous une forme élargie, avec des explications et des ajouts. Il reflète non seulement comment créer un système de gestion de la qualité, obtenir un certificat ISO pour celui-ci, mais également l'utiliser pour améliorer les activités de l'organisation. Les trois normes désignées sont étroitement liées.
Le système de gestion de la qualité actuel a été développé et mis en œuvre en stricte conformité avec les exigences des normes nationales de la Fédération de Russie GOST R 52249-2009 (GMP) "Règles pour la production et le contrôle de la qualité des médicaments" et GOST R ISO 9001-2008 (ISO 9001 : 2008) « Systèmes de gestion de la qualité. Conditions".
La norme BPF russe a été préparée par l'Association des ingénieurs de contrôle de la micropollution (ASINCOM). En 2004, il a été approuvé par le décret du Gosstandart de Russie du 10 mars 2004 n ° 160-st GOST R 52249-2004 «Règles pour la production et le contrôle de la qualité des médicaments», qui est harmonisé avec les règles des BPF ( Bonnes pratiques de fabrication des médicaments) de l'Union européenne. L'arrêté du ministère de la Santé et du ministère de l'Économie est entré en vigueur le 1er janvier 2005, et le respect des règles GMP dans la production pharmaceutique dans la Fédération de Russie est obligatoire.
L'assurance qualité des médicaments (MP) est l'une des tâches les plus importantes de la pharmacie moderne. Pour standardiser et unifier le processus d'assurance de la qualité des médicaments au stade de leur livraison directe aux patients (liaison détail de distribution des médicaments), il est reconnu utilisation nécessaire principes et méthodes des normes de Bonnes Pratiques Pharmaceutiques (BPP). Une organisation pharmaceutique, en termes de normes ISO, est un groupe d'employés et fonds nécessaires avec la répartition des responsabilités, des pouvoirs et des relations qui exercent des activités pharmaceutiques dans les établissements pharmaceutiques tels qu'une pharmacie, un point, un kiosque, un magasin, etc. ...
Une condition préalable à la mise en œuvre des activités pharmaceutiques est l'assurance qualité dans les entreprises de vente en gros et dans les organisations pharmaceutiques, qui se reflète dans les OST. La première étape dans la création d'un cadre juridique la réglementation du marché pharmaceutique, en tenant compte des normes internationales, est l'adoption des normes industrielles suivantes :
OST91500.05.005-2002 "Règles pour le commerce de gros des médicaments. Dispositions de base", approuvée par arrêté du ministère de la Santé de la Fédération de Russie du 15/03/2002 n° 80 ;
OST 91500.05.0007-2003 "Règles pour la délivrance (vente) de médicaments dans les organisations pharmaceutiques. Dispositions de base", approuvée par arrêté du ministère de la Santé de la Fédération de Russie du 04.03.2003 n° 80.
3. Systèmes de management de la qualité pour les activités pharmaceutiques en pharmacie
Les problèmes de création d'un système efficace de gestion de la qualité des médicaments (médicaments) dans une pharmacie se reflètent dans les publications d'un certain nombre de scientifiques nationaux : D.V. Parkhomenko, I. G. Komissinskaya, Z.K. Drugovoy, A.M. Biteryakova, S.V. Kononov et autres.
Un système est un ensemble de principes interdépendants et interactifs. Chaque système a une soi-disant entrée - c'est-à-dire des processus et des valeurs matérielles qui initient des actions, leurs propres processus se déroulent au sein du système. Le système de gestion de la qualité dans le domaine de la circulation des médicaments en Russie est déterminé par la loi fédérale n° 86 "sur les médicaments", et ses principales étapes sont enregistrement d'un médicament, autorisation de production d'un médicament et autorisation d'activités pharmaceutiques .
Conformément à l'article 45 de cette loi, une responsabilité professionnelle particulière est assignée aux employés de la pharmacie pour fournir au consommateur des soins médicaux de haute qualité. Les dommages liés aux atteintes à la santé résultant de l'utilisation de médicaments devenus inutilisables à la suite d'infractions aux règles de l'activité pharmaceutique seront indemnisés par l'organisation par la faute de laquelle l'infraction a été commise.
La complexité, la nature en plusieurs étapes et la durée du « cycle de vie du médicament » - de sa création à sa réception par l'utilisateur final - prédéterminent la nécessité d'introduire un système préventif efficace de gestion de la qualité des médicaments qui empêche les médicaments de qualité inférieure d'entrer sur le marché pharmaceutique. Sur le chemin d'un médicament du fabricant au consommateur, le dernier maillon où la qualité d'un médicament est évaluée par des spécialistes qualifiés est la pharmacie. La gestion de la qualité en pharmacie est basée sur les principes TQM et les normes de la série ISO 9000.
V pharmacie un système de gestion de la qualité doit être constitué, dont l'une des fonctions est de contrôler le respect des exigences des documents réglementaires du système de normalisation en matière de soins de santé, en particulier les OST précités. L'objectif principal de la création d'un système efficace de gestion de la qualité des médicaments (médicaments) et des activités pharmaceutiques dans une pharmacie est de garantir que le consommateur peut acheter des médicaments de bonne qualité et recevoir des services pharmaceutiques de haute qualité. .
OST 91500.05.0007-2003 "Règles pour la distribution (vente) de médicaments dans les organisations pharmaceutiques, dispositions de base" (approuvées par l'arrêté du ministère de la Santé de la Russie) réglemente les règles de vente au détail dans les organisations pharmaceutiques, à l'article 9, le paragraphe 9.1 dit : " gestion de la qualité ". A l'article 9.9 il est indiqué : « Le responsable de l'organisation pharmaceutique nomme un délégué qualité parmi le personnel d'encadrement.
Les services pharmaceutiques ont une valeur élevée pour le consommateur, car ils font partie des types de services intelligents qui contribuent au maintien et à la préservation de la santé humaine. Une valeur élevée pour le consommateur prédétermine la légitimité des prix élevés de ces services.
Les résultats des services sont généralement retardés et différenciés, ce qui détermine approche spécialeà la formation des prix des services et à un régime spécial de financement des organisations pharmaceutiques. Le consommateur de services pharmaceutiques est à la fois un individu et la société dans son ensemble.
Ces caractéristiques définissent une double approche du problème de la qualité des services pharmaceutiques. Premièrement, l'amélioration de la qualité est l'un des principaux facteurs de l'avantage concurrentiel d'une organisation pharmaceutique et de la maximisation des profits. C'est pourquoi la problématique de la qualité des services pharmaceutiques commence au centre des intérêts économiques de l'organisation et permet de renforcer sa stabilité économique. D'autre part, la qualité des services pharmaceutiques est condition essentielle ils remplissent leur fonction sociale - fournir des soins pharmaceutiques de haute qualité et, finalement, maintenir la santé humaine. Une organisation pharmaceutique ne peut considérer qu'elle a atteint ses buts et objectifs que si elle a assuré un haut niveau de qualité des services fournis. C'est pourquoi il est nécessaire de développer un système qualité dans une organisation, ou plutôt un système de management de la qualité.
La qualité des services pharmaceutiques se compose de deux composantes principales : qualité des médicaments (médicaments) et la qualité des activités pharmaceutiques.
Qualité des médicaments est déterminé par les composants suivants :
Détermination des besoins du marché (qualité du choix du consommateur);
Qualité de la conception des médicaments ;
La qualité du processus de production ;
Respect de la qualité du produit final au projet ;
Qualité du service après-vente.
Les principales propriétés qui déterminent la qualité des produits pharmaceutiques et médicaux comprennent :
Sécurité- l'état de la marchandise dans conditions normales son utilisation, son stockage, son transport et son élimination, dans lesquels le risque d'atteinte à la vie, à la santé et aux biens du consommateur est limité à un niveau acceptable.
propriétés fonctionnelles ... Ils déterminent l'aptitude des produits à remplir leurs fonctions comme prévu dans des conditions d'utilisation ou de consommation spécifiées.
N fiabilité... Dans de nombreux cas, la sécurité d'un produit est déterminée par sa fiabilité, c'est-à-dire la propriété de conserver ses caractéristiques d'origine pendant une longue période dans certaines limites pendant l'exploitation.
respect de l'environnement... Il caractérise le degré effets néfastes fournitures médicales pour environnement survenant au stade de toute la vie du produit. Indicateurs environnementaux : niveau d'émissions chimiques dangereuses, rayonnement, concentration produits dangereux ainsi que la capacité d'être recyclable.
esthétique- un indicateur d'appréciation qualitative et quantitative de la valeur esthétique des produits, en fonction du groupe de consommateurs, des conditions particulières de consommation et de la destination du produit.
la consommation de ressources... Il se caractérise par les coûts du consommateur pour l'achat, le fonctionnement et l'entretien du produit pendant la période de la ressource technique moyenne, c'est-à-dire avant de mettre le produit hors service.
Évaluation de la qualité des médicaments
La qualité des médicaments est évaluée conformément aux Instructions pour l'évaluation de la qualité des médicaments fabriqués dans les pharmacies (arrêté du ministère de la Santé de Russie du 10.16.97 n° 305) "Sur les normes d'écarts admissibles dans la fabrication de médicaments et conditionnement de produits industriels en pharmacie"). Cet arrêté s'applique à toutes les officines, officines (ayant le droit de fabriquer des médicaments) et laboratoires territoriaux de contrôle et d'analyse qui contrôlent la qualité des médicaments fabriqués en officine.
La qualité des médicaments (y compris les médicaments homéopathiques) fabriqués en pharmacie est établie par un ensemble d'indicateurs. Le niveau de qualité des médicaments est évalué conformément aux exigences réglementées par le Fonds d'État actuel, les ordonnances et les instructions du ministère de la Santé de la Russie.
Pour évaluer la qualité, les termes « Satisfait » (« Bon produit ») et « Non satisfait » (« Mariage ») sont utilisés. Le niveau de qualité des médicaments fabriqués est déterminé par des méthodes organoleptiques et de mesure.
L'insatisfaction des médicaments fabriqués est établie selon les indicateurs suivants :
Incohérence dans la description ( apparence, couleur, odeur);
· Incohérence dans la transparence ou la couleur ;
· Incohérence dans la désintégration;
· Hétérogénéité de broyage ou de mélange de poudres, pommades, suppositoires, triturations homéopathiques ;
· Présence d'inclusions mécaniques visibles;
· Incohérence de la recette de l'authenticité ;
· Remplacement erroné d'un LV par un autre, absence de prescription ou présence d'une substance non enregistrée ;
Remplacement de médicaments par des médicaments similaires action pharmacologique sans indiquer ce remplacement sur la demande, ordonnance (copie de l'ordonnance, étiquette) ;
· Les écarts par rapport à la prescription en poids ou en volume ;
· Écarts de masse totale (volume);
· Les écarts dans la masse des doses individuelles et leur nombre ;
· Écarts dans le poids de l'échantillon (ou dans la concentration) de LV individuel ;
· Discordance dans la valeur du pH ;
· Divergence dans la valeur de densité;
· Divergence de stérilité ;
· Incohérence dans la pureté microbiologique ;
· Violation de la fixation de la fermeture (pour les formes galéniques stériles) ;
· Violation des règles d'enregistrement des médicaments destinés aux vacances.
Les modifications de la composition de la forme posologique (si nécessaire) ne doivent être apportées qu'avec le consentement du médecin et doivent être notées sur l'exigence, l'ordonnance (copie de l'ordonnance, étiquette). En l'absence de mention précise sur l'exigence, la recette (copie de la recette, étiquette), la qualité de fabrication de la forme galénique est évaluée comme « Insatisfaisant ».
Les changements dans la quantité de médicaments délivrés ou la délivrance de comprimés au lieu de poudres doivent également être notés sur la demande, la prescription, etc.
Lors de la détermination des écarts dans les formes posologiques testées, des instruments de mesure du même type (avec les mêmes caractéristiques métrologiques) doivent être utilisés que lors de leur fabrication en pharmacie.
Les normes de dérogations autorisées dans la fabrication de DF (y compris les médicaments homéopathiques) dans les pharmacies ont été établies (arrêté du ministère de la Santé de Russie du 10.16.97 n° 305).
Lors de la détermination des écarts admissibles dans les médicaments testés, fabriqués sous la forme d'une série de blancs intra-pharmacie, les taux d'écart ci-dessus doivent être utilisés, ainsi que la documentation réglementaire actuelle régissant la production et le contrôle de la qualité de diverses formes posologiques dans les pharmacies. .
La qualité des activités pharmaceutiques
Le marché des services pharmaceutiques a des limites territoriales clairement définies. Dans le cadre du fonctionnement du marché pharmaceutique, le contrôle de l'État est nécessaire, car les services pharmaceutiques sont un bien public et il faut éviter leur monopolisation. L'État exerce des fonctions liées principalement à la réglementation juridique, au soutien de l'information et à d'autres aspects de la formation du marché. Ainsi, on peut parler d'une certaine double nature des services pharmaceutiques. D'une part, il s'agit d'un produit qui a sa propre valeur de consommation et qui est capable de faire l'objet de relations marchandes. La mise en œuvre, dans ce cas, doit être de nature commerciale et poursuivre l'objectif d'obtenir un profit maximum.
D'autre part, les services pharmaceutiques sont bon public, dont les caractéristiques distinctives sont l'indivisibilité, la nature conjointe de la consommation, la haute signification sociale, la prédominance de la propriété publique et de l'État dans leur production et leur consommation. Du point de vue du consommateur, les organisations pharmaceutiques fournissent un service complet, répondant aux besoins sociaux les plus importants, à la fois d'un individu et de la société dans son ensemble. Une caractéristique importante c'est aussi le fait que la prestation de services pharmaceutiques exige le respect de certaines normes morales et éthiques. Tout cela rend difficile quantification activité, ce qui limite l'utilisation de principes commerciaux d'activité dans les activités pharmaceutiques.
Il s'ensuit qu'un système de gestion de la qualité des médicaments est généralement compris comme un ensemble de mesures organisationnelles qui assurent la fourniture de soins médicamenteux de qualité au consommateur, qui est une combinaison de la qualité des médicaments eux-mêmes et de la qualité des activités pharmaceutiques de l'organisation de la pharmacie. La situation actuelle dans le domaine de la gestion de la qualité nécessite le développement d'approches pratiques et de principes de gestion pour résoudre le problème d'assurer la disponibilité de médicaments de haute qualité à la population dans chaque organisation pharmaceutique.
4. Mise en place d'un système de management de la qualité
médicaments en pharmacie
Ordonnance du ministère de la Santé de la Fédération de Russie n° 80 du 04/03/2003 « Sur l'approbation de la norme de l'industrie » Règles pour la délivrance (vente) de médicaments dans les organisations pharmaceutiques. Dispositions de base". Contient la section IX Assurance qualité des médicaments (médicaments) dans les organisations pharmaceutiques.
Les organisations pharmaceutiques ou les entrepreneurs individuels devraient avoir un système d'assurance qualité qui comprend :
Des locaux et équipements correspondant au périmètre d'activités de l'établissement pharmaceutique et permettant de s'assurer du respect des conditions de stockage et de fabrication des médicaments ;
Une documentation qui vous permet d'identifier l'origine, la quantité et la qualité des médicaments entrants et de tenir des registres des médicaments stockés et vendus ;
Contrôle entrant de ceux qui entrent dans l'organisation de la pharmacie ou entrepreneur individuel Médicaments;
Personnel ayant les qualifications requises ;
Système de formation continue du personnel ;
Les descriptions d'emploi;
Le fonds de documents normatifs et de référence avec lequel toutes les installations pharmaceutiques d'une organisation pharmaceutique donnée devraient être fournies.
L'organisation pharmaceutique doit disposer d'un système de gestion de la qualité pour l'organisation pharmaceutique.
Chaque organisation pharmaceutique doit avoir un règlement interne du travail approuvé par le chef de l'organisation, avec une marque sur la familiarisation des employés. La révision des règles et la re-familiarisation avec celles-ci des employés de l'organisation de la pharmacie sont effectuées chaque année.
L'organisation de la pharmacie doit effectuer régulièrement des contrôles internes de conformité aux exigences de GOST. Lors des inspections, il convient de prêter attention à la disponibilité dans l'organisation de la pharmacie des documents pertinents pour les locaux occupés, des descriptions de poste des employés, des normes et des autres documents nécessaires.
Les inspections peuvent être effectuées à la fois par des employés de l'organisation pharmaceutique, indépendants des personnes exerçant directement l'activité inspectée, et par des experts indépendants. La fréquence des contrôles est déterminée par l'organisation pharmaceutique elle-même. Les résultats des inspections sont enregistrés et portés à la connaissance du personnel responsable de la zone de travail inspectée et de la direction de l'organisation de la pharmacie. Lors de contrôles ultérieurs, la mise en œuvre des recommandations et leur efficacité sont contrôlées. Chaque employé d'une organisation pharmaceutique doit connaître GOST, la procédure à suivre pour s'acquitter des tâches qui lui sont assignées, les actes juridiques réglementaires et les normes liées aux activités de l'organisation. Les organisations pharmaceutiques doivent avoir des descriptions de poste pour chaque employé, approuvées dans l'ordre approprié.
Les organisations pharmaceutiques doivent prévoir un système de développement professionnel continu des employés sur la législation en vigueur, l'utilisation des médicaments, etc. Le plan et les thèmes des cours sont approuvés par le chef de l'organisation pharmaceutique. Le responsable de l'organisation de la pharmacie désigne un représentant qualité parmi le personnel de gestion.
À cet égard, il n'y a aucun doute sur la nécessité d'une amélioration continue des compétences professionnelles du personnel pharmaceutique. L'un des moyens de résoudre ce problème est d'augmenter l'efficacité du système de formation postuniversitaire des pharmaciens.
L'organisation pharmaceutique assure la tenue de la documentation conformément aux actes juridiques législatifs et réglementaires de la Fédération de Russie.
Tout d'abord, la tâche de la pharmacie est de fournir les caractéristiques préservées des marchandises reçues par l'organisation de la pharmacie. Il s'agit de deux groupes : les qualités fonctionnelles - efficacité et sécurité, physiques et physico-chimiques, nécessitant le respect des règles de manipulation. Dans le cadre du système de gestion de la qualité d'une organisation pharmaceutique, chaque pharmacie doit organiser :
1. Contrôle de réception... Elle est effectuée afin d'empêcher la réception et la vente de produits contrefaits, rejetés et de qualité inférieure à travers le réseau de pharmacies. Il est réglementé par la norme industrielle OST 91500.05.0007.-2003 « Règles pour la délivrance (vente) de médicaments dans les organisations pharmaceutiques ». Les zones (locaux) de réception et de distribution des médicaments doivent être séparées de la zone de stockage et doivent assurer une protection adéquate (fiable) des médicaments reçus contre les intempéries pendant les opérations de chargement (déchargement). Les produits qui en résultent sont soumis à un contrôle qualité entrant. Les résultats du contrôle entrant doivent être enregistrés conformément à la procédure interne établie à la pharmacie. Lors du déchargement, les produits sont contrôlés quant à la conformité à la commande et à l'absence de détérioration des colis ou conteneurs. Les médicaments et autres produits approuvés à la vente par des organisations pharmaceutiques dont la durée de conservation est expirée, ne répondant pas aux exigences de qualité, aux normes et sans documents certifiant leur qualité ne sont pas soumis à acceptation. Pour les médicaments (médicaments) dans des emballages endommagés ne disposant pas des certificats et/ou des documents d'accompagnement nécessaires, refusés lors de la réception ou de la délivrance au patient, ne correspondant pas à la commande ou ayant une durée de conservation expirée, un acte est établi ; ils doivent être étiquetés de manière appropriée et placés dans une zone désignée séparée des autres médicaments jusqu'à ce qu'ils soient identifiés, renvoyés au fournisseur ou détruits conformément à la procédure établie. toxique et substances puissantes, les stupéfiants, les substances psychotropes, les médicaments thermolabiles doivent être immédiatement placés dans des locaux de stockage conformément aux exigences du présent OCTa.
Le nombre de médicaments pris nécessitant des conditions de stockage particulières doit correspondre à la capacité disponible des équipements spéciaux. Les médicaments acceptés et autres produits autorisés à être délivrés par les organisations pharmaceutiques sont crédités dans le délai imparti pour l'acceptation des produits par le nombre d'unités de produits et l'intégralité de la manière prescrite. 6. Toute livraison de la marchandise doit être accompagnée de documents permettant d'établir la date d'expédition, le nom du médicament (y compris la forme galénique et la posologie), le lot et le numéro de lot, la quantité de la marchandise livrée, le prix du médicament délivré, le nom et l'adresse du fournisseur et du destinataire, ainsi que les documents attestant de la qualité des médicaments. Les documents confirmant la qualité des médicaments sont une déclaration de conformité ou un certificat de conformité. Un indicateur important est qu'une pharmacie ou une chaîne de pharmacies travaille avec un maillon de gros fiable, des sociétés transnationales bien connues, qui ont leur propre "service de sécurité des médicaments". " pris très au sérieux.
Le contrôle d'acceptation, ainsi que la vérification de l'exactitude des documents, comprend la vérification des médicaments selon les indicateurs "Description", "Emballage", "Marquage", qui est déterminé par les exigences de l'arrêté du ministère de la Santé de la Fédération de Russie du 07.16. .97. N° 214 "Sur le contrôle de la qualité des médicaments fabriqués dans les organisations pharmaceutiques (pharmacies)". Le contrôle selon l'indicateur "Description" comprend la vérification de l'apparence, de la couleur, de l'odeur. L'incohérence de la couleur, la présence d'odeur étrangère, les sédiments, les flocons, les impuretés mécaniques, le gel, la stratification sont des motifs de rejet. En cas de doute sur la qualité des médicaments, des échantillons sont envoyés au centre territorial de contrôle qualité des médicaments. Ces médicaments portant la mention : « Rejeté lors du contrôle de réception » sont stockés dans la pharmacie séparément des autres médicaments. Le contrôle selon l'indicateur « Emballage » comprend la vérification de l'intégrité de l'emballage, la présence d'un emballage secondaire et la conformité de l'emballage avec les propriétés physico-chimiques des médicaments.
2. Locaux et équipements. Les exigences de base concernant l'organisation du stockage des médicaments et des produits médicaux dans les pharmacies sont établies par l'Instruction sur l'organisation du stockage dans les pharmacies de différents groupes de médicaments et de fournitures médicales. Les médicaments nécessitant des conditions de conservation particulières doivent être immédiatement identifiés et placés dans des salles de stockage (zones) selon les exigences de la législation en vigueur. La salle de stockage de la pharmacie doit être suffisamment grande pour permettre le stockage ordonné des différentes catégories de matériaux et de produits. Propre et sécurisé. Les médicaments dans les entrepôts de production doivent être stockés sur des racks, des palettes, des dosettes, dans des armoires, des équipements de réfrigération et d'autres équipements spéciaux afin de garantir des conditions de stockage des médicaments conformes aux exigences en vigueur. . S'il y a des préparations immunobiologiques dans la base de la pharmacie (entrepôt), le volume total des équipements de réfrigération doit assurer, conformément aux exigences en vigueur, le stockage de la totalité de ces médicaments, qui est contenue dans la base (entrepôt). Lors du stockage de médicaments, le titulaire de l'autorisation est tenu d'exclure leurs dommages (renversement, renversement, bris), la contamination par des micro-organismes et la contamination croisée. Le stockage des médicaments nécessite des conditions de température particulières, contrôlées par des dispositifs de surveillance à température constante ou des conteneurs thermiques.
3... Personnel... Un troisième principe de gestion s'applique aux ressources : l'implication des salariés. Ce sont les employés de tous les niveaux qui forment l'épine dorsale de l'organisation. Leur pleine implication permet à l'organisation de bénéficier de leurs capacités. D'une part, la décision de gestion que le système de gestion doit fonctionner, et d'autre part, seulement lorsque l'ensemble du personnel se rend compte que le système de gestion n'est pas une simple collection de feuilles de papier supplémentaires qui seront sur l'étagère. Ce doit être une structure efficace, et cela ne fonctionnera que lorsque tout le monde comprendra sur quoi elle est basée et pourquoi elle est faite. Dans chaque pharmacie, sous une forme ou une autre, un système de gestion de la qualité a été créé et fonctionne avec succès - pour certains, il est de 10 %, pour certains, il est de 90 %.
4. Documentation Les opérations affectant la qualité des marchandises doivent être décrites dans des procédures écrites. Le système de gestion de la qualité vise à systématiser les processus, à voir si tous sont dotés des ressources et des documents nécessaires. Il est important de savoir si tous les processus ont des procédures et des règles documentées pour leur mise en œuvre. Le processus de révision et d'amélioration est nécessaire pour prendre des décisions de gestion factuelles - c'est le septième principe de gestion des normes ISO. Les décisions efficaces reposent sur l'analyse des données et des informations.
7. Remboursements... La présence de médicaments de qualité inférieure ou falsifiés en circulation, à l'exclusion de ceux dont la durée de conservation est dépassée, n'est pas autorisée. Après avoir identifié le fait de la présence de médicaments de qualité inférieure, contrefaits et similaires, l'entité commerciale doit rédiger un acte approprié et prendre des mesures pour les exclure de la circulation. L'exclusion de ces médicaments de la circulation se fait par élimination et destruction conformément aux règles d'élimination des médicaments. Une procédure a été développée pour travailler avec des lettres de Roszdravnador concernant des produits rejetés et falsifiés pour les spécialistes du Centre conformément aux exigences et sous les formes spécifiées dans la lettre du Service fédéral de surveillance de la santé et du développement social du 28/09/2004 . n° 4082/04.
5. Optimisation du système de management de la qualité des activités pharmaceutiques en officine
À la suite de l'étude de la littérature sur la gestion de la qualité PL, il est possible de proposer d'optimiser les activités des organisations pharmaceutiques en introduisant les principes suivants :
La qualité de gestion est un concept à multiples facettes, elle comprend de nombreuses composantes, telles que : la transparence et la contrôlabilité des processus, la qualité de l'information, la possibilité de contrôle opérationnel des activités en cours, et bien plus encore. Parallèlement, divers documents sont pratiquement le seul outil de mise en œuvre de la gestion. Ainsi, le moyen évident de changer la qualité de la gestion d'entreprise est d'améliorer l'efficacité du travail avec les documents.
La gestion de la qualité en pharmacie repose sur les principes suivants :
Assortiment et volume suffisants de médicaments à des prix abordables
La tâche de la pharmacie n'est rien de plus que de fournir à la population des médicaments et des produits pharmaceutiques au bon endroit et à un moment convenable pour les visiteurs, pour lesquels les besoins sont déterminés, un fournisseur, une demande est faite, un achat est fait et un la posologie est étudiée.
Accessibilité sociale
Recherche sur l'assortiment dans les synonymes et les analogues. La pharmacie contient plus d'un nom commercial d'une substance active. Les noms commerciaux varient parfois de 100 à 700%, selon le fabricant. La pharmacie achète différentes marques à différents niveaux pour assurer l'inclusion sociale des différents groupes sociaux de visiteurs. Dans un groupe pharmacothérapeutique, vous pouvez prendre à la fois des médicaments coûteux et des médicaments à coût moyen et faible.
- Accompagnement information et conseil
Les pharmaciens doivent anticiper les attentes des consommateurs et s'assurer que le produit répond à ces attentes. Ce n'est pas toujours possible. Par exemple, un consommateur souhaite consulter un pharmacien avant d'acheter un médicament. Mais un pharmacien n'est pas un médecin et n'a aucune responsabilité légale pour la santé du patient dans notre pays. Cependant, n'obtenant pas ce qui était attendu, le consommateur reste insatisfait.
- Mise en place de systèmes informatiques en officine et utilisation des codes-barres dans le contrôle qualité des médicaments en officine
Le système d'automatisation de pharmacie diffère des systèmes d'automatisation de vente au détail. Les pharmacies ont beaucoup de spécificités propres, principalement liées à la tarification, qui en Russie a toujours été un processus complexe et déroutant. La tarification en pharmacie s'effectue selon certains documents législatifs et est strictement réglementée ; il existe une liste de médicaments qui ne sont pas taxés. Le prix de détail est formé différemment pour ces médicaments. Auparavant, le processus de réception des marchandises et d'enregistrement des prix pour les employés de la pharmacie était laborieux et prenait du temps. Par conséquent, l'automatisation est tout simplement indispensable ici.
Les systèmes d'automatisation permettent aux pharmaciens d'afficher des données sur ce qui est en stock, quels médicaments sont épuisés et ce qui doit être acheté. Le processus de visualisation rapide des soldes réels est l'un des plus importants lors du choix d'un système d'automatisation.
Dans toute pharmacie ordinaire, où il y a une simple caisse enregistreuse, lors d'un achat, l'argent que nous payons au caissier n'est en aucun cas directement lié aux marchandises que nous recevons.
Et ici plusieurs problèmes se posent à la fois :
Premièrement, la pharmacie manque d'une comptabilité complète et détaillée des mouvements de biens et de fonds. Il est impossible, par exemple, à un moment donné de dire quelle quantité d'un produit donné a été vendue, est restée dans la salle des marchés ou dans un entrepôt, il est impossible d'interdire automatiquement le poinçonnage d'un produit déjà terminé, etc.
Deuxièmement, il est difficile d'éviter les erreurs que le caissier peut commettre ;
Troisièmement, l'absence d'une comptabilité détaillée ne permet pas de réaliser des statistiques et une analyse détaillée de la dynamique des ventes, ce qui rend difficile une réponse plus souple aux évolutions de la demande.
6. Analyse et moyens d'améliorer le système de gestion de la qualité des médicaments dans la pharmacie de la SARL "MAIR"
MAIR LLC opère sur le marché pharmaceutique depuis plus de 15 ans dans le territoire de Primorsky. Son réseau de pharmacies regroupe 5 points de vente et est très populaire - plusieurs milliers d'habitants de Vladivostok ont des cartes de fidélité. Occupe le deuxième étage d'un immeuble de 2 étages. Le local de la pharmacie est neuf, fonctionne depuis mai 2010, répond à toutes les exigences des MTN et des normes sanitaires, fonctionne de 9h00 à 20h00 sept jours sur sept. Il y a des panneaux indiquant le nom de la pharmacie et les heures d'ouverture. Situé dans un endroit pratique pour les visiteurs, près de l'arrêt de bus.
Mair considère que sa mission principale n'est pas tant la vente de médicaments, la vente de produits pharmaceutiques et de médicaments, de produits médicaux, mais la fourniture de services pharmaceutiques de haut niveau, c'est pourquoi la société s'efforce de se concentrer sur le client, de garantir la qualité des médicaments, et servir au mieux l'acheteur. Tout cela, associé à un désir compréhensible de rendre leur travail plus efficace, a amené la direction à réfléchir à la mise en place d'un système de gestion de la qualité.
Ayant travaillé sur un système de gestion de la qualité pendant moins d'un an, une pharmacie peut tirer quelques conclusions. Des indicateurs objectifs confirment que la mise en place d'un système de management de la qualité a contribué à l'optimisation du fonds de roulement : le volume des ventes dans les pharmacies de la chaîne a augmenté, le nombre de produits à faible revenu et illiquides, ainsi que les produits ayant une durée de conservation expirée, a diminué . Le nombre de clients réguliers a augmenté. L'analyse de leur demande, souhaits et offres a permis de pratiquement se débarrasser des défauts. De plus, en raison de l'orientation du personnel vers le travail avec les clients, non seulement le nombre d'achats en ligne a considérablement augmenté, mais leur coût moyen a été optimisé. Les spécialistes de la gestion de la qualité soulignent actuellement que le lien principal et le plus problématique dans toute structure de gestion est l'humain. Dans notre cas, il s'agit de pharmaciens spécialisés. Ceux qui sont en contact direct avec les clients, les visiteurs, les consommateurs. Pour la mise en place du système de gestion de la qualité en pharmacie, quelques changements ont été apportés dans la structure organisationnelle et dans les relations au sein de l'équipe. Un système efficace de formation du personnel, un suivi constant de la formation ont augmenté la qualité du travail du personnel.
1. À la suite de l'analyse des données de la littérature étrangère et nationale, il a été établi qu'une grande attention est accordée aux problèmes du système de gestion de la qualité des médicaments dans les institutions pharmacologiques en Russie et à l'étranger. Lors de l'étude des concepts de base dans la construction de modèles et le fonctionnement des systèmes de gestion de la qualité, un leadership clair est démontré par des approches basées sur le concept de gestion de la qualité totale (TQM) et les normes de la série ISO 9000, qui fournissent un certain nombre de principes généraux : orientation client, leadership leadership, approche processeur, approche système, amélioration continue, relations mutuellement bénéfiques avec les fournisseurs, etc.
2. Le système de gestion de la qualité dans le domaine de la circulation des médicaments en Russie est déterminé par la loi fédérale n° 86 "sur les médicaments". La gestion de la qualité du travail des organisations pharmaceutiques est basée sur les principes de la TQM et de la série ISO 9000 et normes. normes de l'industrie : OST91500.05.005-2002 "Règles pour le commerce de gros des médicaments. Dispositions de base", approuvées par arrêté du ministère de la Santé de la Fédération de Russie du 15/03/2002 n° 80 ; OST 91500.05.0007-2003.
3. Conformément à la pratique internationale, la pharmacie est entièrement responsable de la qualité des produits achetés auprès des fournisseurs, seules les exigences obligatoires pour les produits sont déterminées par la loi et toutes les autres conditions sont stipulées dans un accord entre les acteurs du marché.
4. Le système de gestion de la qualité dans le domaine de la circulation des médicaments doit être fiable, préventif, empêchant la fourniture de services pharmaceutiques de qualité inférieure au consommateur, ainsi que personnalisé, c'est-à-dire avoir des personnes spécifiques responsables de cela.
5. Certains principes sont considérés qui permettent d'optimiser le système de gestion de la qualité dans le domaine de la circulation des médicaments en pharmacie.En étudiant la littérature sur la gestion de la qualité des médicaments, il est possible de proposer d'optimiser les activités des organisations pharmaceutiques en introduisant les principes suivants.
BIBLIOGRAPHIE
1. Arrêté du ministère de la Santé de la Fédération de Russie du 03/04/2003. N° 80 « Sur l'approbation de la norme de l'industrie » Règles pour la distribution (vente) de médicaments dans les organisations pharmaceutiques. Dispositions de base".
2. Skulkova R.S., Yagudina R.I., Parkhomenko D.V. Formation d'un système de gestion de la qualité pour les organisations pharmaceutiques. Nouvelle pharmacie. Règlements. 2005.-N 4.-С.32-37.
3. Komissinskaya I. G. Concept moderne de gestion de la qualité d'une organisation pharmaceutique // Pharmacies de Moscou. - 2007. - N° 11.
4. Alferova, T.V. Gestion de la production dans les entreprises pharmaceutiques / T.V. Alferova, E.A. Tretiakov, A.V. Builin. - Ekaterinbourg : Maison d'édition de l'Institut d'économie de la branche ouralienne de l'Académie des sciences de Russie, 2008. - 214p.
5. Moskvin V.A. Évolution dans le domaine de la gestion de la qualité / V.A. Moskvin // Investissements en Russie 2004. N° 5.- S. 27-28.
6. Lagutkina T.P. Principes de gestion de la qualité dans les activités d'une organisation pharmaceutique // Bulletin de l'Université de l'amitié des peuples de Russie. 2008.-N 4.-С.36-39.
7. Polesskiy V.A. Évolution des modèles de système qualité : pratique internationale / V.A. Polesskiy, S.A. Martynchik, V.G. Zaporozhchenko, V.Z. Kucherenko // Économie de la santé. - 2005. - N° 8. - Art. 25-36.
8. Loi fédérale "sur les médicaments" n° 86-FZ du 22.06.98
9. Drugova Z.K., Biteryakova A.M. Système de contrôle interne et qualité de gestion // pharmacies russes. – №2. – 2007.
10. Koonova S.V. Le système d'assurance qualité des services pharmaceutiques dans le complexe pharmaceutique régional : monographie. -Nijni Novgorod : Maison d'édition VGIPA, 2003.
11. Conditions de conservation des médicaments. - M. : Médecine, 2006.-- 184p.
12. Kulaev V.A., Egorov V.A., Gladunova E.P., Ezhkov V.N. Système intégré de gestion de la qualité des soins pharmaceutiques // Pharmacie, 2011, n° 3, pp. 30-33
I. Contrôle de réception
une. Un contrôle de réception est effectué afin d'empêcher l'entrée de médicaments de qualité inférieure dans la pharmacie.
b. Le contrôle de réception consiste à vérifier la conformité des médicaments entrants aux exigences des indicateurs suivants : « Description » ; "Emballer"; "Marquage"; en vérifiant l'exactitude des documents de règlement (factures), ainsi que la disponibilité des certificats de conformité du fabricant et d'autres documents confirmant la qualité des médicaments conformément à la réglementation en vigueur. documents réglementaires.
je. Le contrôle selon l'indicateur "Description" comprend la vérification de l'apparence, de la couleur, de l'odeur. En cas de doute sur la qualité des médicaments, des prélèvements sont adressés au laboratoire territorial de contrôle et d'analyse. Ces médicaments portant la mention : « Rejeté lors du contrôle de réception » sont conservés en pharmacie séparément des autres médicaments.
ii. Lors du contrôle de l'indicateur « Conditionnement », une attention particulière est portée à son intégrité et à sa conformité aux propriétés physico-chimiques des médicaments.
iii. Lors du suivi de l'indicateur « Marquage », l'attention est attirée sur la conformité des médicaments aux exigences en vigueur.
iv. Attention particulière doit être payé pour la conformité de l'étiquetage des emballages primaire, secondaire et de groupe, la présence d'une notice en russe dans l'emballage (ou séparément dans un emballage pour toute la quantité de médicaments finis).
v. Sur les étiquettes des emballages contenant des substances médicamenteuses destinées à la fabrication de solutions injectables et pour perfusion, il doit y avoir une mention « Convient à l'injection ». Les emballages contenant des drogues toxiques et narcotiques doivent être conçus conformément aux exigences de la législation de la Fédération de Russie et des documents réglementaires.
vi. Les matières premières de plantes médicinales reçues de la population sont contrôlées selon l'indicateur " Signes extérieurs»Conformément aux exigences de la pharmacopée d'État ou du document réglementaire en vigueur, après quoi il est envoyé pour analyse au laboratoire territorial de contrôle et d'analyse.
II. Mesures préventives
1. Les mesures préventives doivent satisfaire aux exigences suivantes :
une. Respect des normes et règles sanitaires ; régime anti-épidémique, ainsi que les conditions de production aseptique des médicaments conformément aux documents réglementaires en vigueur.
b. Respect des règles de réception, de collecte et de stockage de l'eau purifiée, de l'eau pour injection ; désinfection en temps opportun du pipeline; contrôle du retrait en temps opportun des solutions stériles, de l'eau purifiée, de l'eau pour injection pour les tests de stérilité conformément aux exigences en vigueur.
2. Les collections pour eau purifiée, eau pour injection doivent avoir une inscription claire : "Eau purifiée", "Eau pour injection". Une étiquette est apposée sur le collecteur d'eau indiquant la date de réception, le numéro d'analyse et la signature de la personne qui l'a vérifiée. Lorsque vous utilisez plusieurs collections en même temps, elles doivent être numérotées.
une. Assurer l'état de fonctionnement et l'exactitude des instruments, appareils et installations de pesage, leurs contrôles de régularité.
b. Examen attentif des prescriptions et des exigences des organismes médicaux arrivant à la pharmacie afin de vérifier l'exactitude de leur prescription ; la compatibilité des substances qui composent les médicaments ; la conformité des doses prescrites avec l'âge du patient et la disponibilité d'instructions sur la façon d'utiliser les médicaments.
c. Conformité à la technologie des médicaments (y compris les médicaments homéopathiques) conformément aux exigences de la pharmacopée d'État en vigueur, des documents réglementaires, des directives.
ré. Mise à disposition des conditions de conservation des médicaments en pharmacie conformément à leurs propriétés physico-chimiques et les exigences de la Pharmacopée d'État, les documents réglementaires en vigueur.
je. Dans les locaux de stockage, sur tous les bars contenant des médicaments, doivent être indiqués : le numéro de lot du fabricant, le numéro d'analyse du laboratoire de contrôle et d'analyse (centre de contrôle qualité des médicaments), la date de péremption, la date de remplissage et la signature du remplissage dans la barre. Sur les barres contenant des médicaments contenant des glycosides cardiaques, le nombre d'unités d'action dans un gramme de matière végétale médicinale ou dans un millilitre de médicament doit être indiqué.
ii. Dans les salles des assistants, sur tous les bars contenant des substances médicamenteuses, doivent être indiqués : la date de remplissage, la signature de la personne qui a rempli le bar et qui a vérifié l'authenticité de la substance médicamenteuse. Sur les barres contenant des substances médicinales toxiques et puissantes, les doses uniques et quotidiennes les plus élevées doivent être indiquées, et sur les barres contenant des substances médicinales destinées à la fabrication de formes posologiques stériles, il doit y avoir une inscription d'avertissement "Pour les formes posologiques stériles".
iii. Les supports contenant des solutions, des teintures et des produits semi-finis liquides doivent être fournis avec des gouttelettes ou des pipettes normales. Le nombre de gouttes dans un certain volume doit être établi par pesée et indiqué sur la tige.
iv. Le remplissage de la tige, de la burette dans une unité de burette, de la tige avec un compte-gouttes normal ou de la pipette ne doit être effectué qu'après pleine utilisation médicament et un traitement approprié de la tige.
e. La nomenclature des concentrés, produits semi-finis et préparation intra-pharmacie des médicaments fabriqués en officine doit être approuvée par le laboratoire territorial de contrôle et d'analyse et communiquée à toutes les pharmacies du territoire correspondant. Cette liste ne peut comprendre que des recettes contenant des substances médicamenteuses compatibles pour lesquelles il existe des méthodes analytiques de lutte chimique*.
F. Les responsables de pharmacie doivent contrôler une fois par trimestre le respect des règles de stockage des médicaments dans les services des organisations médicales rattachées à la pharmacie.
3. Dans les départements des organisations médicales, il est interdit de fabriquer des médicaments, de les emballer, de passer d'un conteneur (emballage) à un autre et de remplacer les étiquettes. Les médicaments doivent être conservés dans les départements uniquement dans leur emballage d'origine (usine, usine ou pharmacie).
4. Pour contrôler la date de péremption, la série du fabricant doit être indiquée sur l'emballage de l'emballage délivré par la pharmacie au service de l'organisation médicale.
5. Les médicaments des pharmacies aux organisations médicales ne devraient être distribués qu'au personnel médical autorisé.
III. Contrôle écrit
1. Lors de la fabrication de formes posologiques conformément aux prescriptions et aux exigences des organisations médicales, des passeports de contrôle écrits sont remplis. Le passeport doit indiquer : la date de fabrication, le numéro de l'ordonnance (numéro de l'organisme médical, le nom du service), le nom des substances médicamenteuses prises et leur quantité, le nombre de doses, les signatures du fabricant , qui a emballé et vérifié la forme posologique. Dans le cas de la fabrication d'une forme galénique, le stagiaire signe le responsable de la pratique de fabrication.
2. Tous les calculs doivent être effectués avant la fabrication de la forme posologique et enregistrés sur verso passeports. Le passeport est rempli immédiatement après la préparation de la forme posologique, de mémoire, pour Latin, conformément à la séquence des opérations technologiques. Lorsque vous remplissez un passeport pour l'homéopathie formes posologiques les noms homéopathiques des médicaments pris séquentiellement sont indiqués.
3. En cas d'utilisation de produits semi-finis et concentrés, le passeport indique leur composition, concentration, volume ou poids prélevé. Dans la fabrication de poudres, suppositoires et pilules, le poids total, le nombre et le poids des doses individuelles sont indiqués. La masse totale des pilules ou des suppositoires, la concentration et le volume (ou la masse) des substances isotonisantes et stabilisantes ajoutées aux collyres, aux solutions injectables et aux perfusions doivent être indiqués non seulement dans les passeports, mais également sur les ordonnances.
4. Le passeport doit indiquer les formules de calcul et les coefficients d'absorption d'eau pour les matières végétales médicinales utilisées dans ce cas, les coefficients d'augmentation du volume des solutions lors de la dissolution de substances médicinales, les coefficients de substitution dans la fabrication de suppositoires.
5. La conservation des passeports de contrôle écrit est également nécessaire si les formes posologiques sont fabriquées et délivrées par la même personne. Dans ce cas, le passeport est rempli lors de la fabrication de la forme galénique.
6. Les passeports de contrôle écrit sont conservés en pharmacie dans un délai de deux mois à compter de la date de fabrication du médicament.
7. Les médicaments fabriqués, les ordonnances et les passeports remplis sont soumis pour vérification à un pharmacien qui exerce des fonctions de contrôle dans la fabrication et la délivrance des médicaments (ci-après dénommé le «pharmacien-technologue»). Le contrôle consiste à vérifier la conformité des inscriptions au passeport avec le contrôle écrit de la recette dans la recette, l'exactitude des calculs. Si un contrôle complet de la qualité chimique d'un médicament a été effectué par un pharmacien-analyste, alors le numéro d'analyse et la signature du pharmacien-analyste sont apposés sur le passeport.
8. Dans la fabrication de concentrés, de produits semi-finis, de préparation intra-pharmaceutique et d'emballage de médicaments, tous les enregistrements sont effectués dans les livres des travaux de laboratoire et d'emballage.
IV. Contrôle de l'enquête
1. Le contrôle de l'enquête est appliqué de manière sélective. Elle est réalisée après la fabrication de cinq formes galéniques au maximum par le pharmacien.
2. Lors d'un contrôle d'enquête, le pharmacien technologue nomme la première substance incluse dans la forme posologique et, dans les formes posologiques d'une composition complexe, indique également sa quantité, après quoi le pharmacien nomme toutes les substances médicamenteuses prises et leurs quantités. Lorsqu'il utilise des produits semi-finis (concentrés), le pharmacien nomme également leur composition et leur concentration.
1. A titre exceptionnel, la production d'eaux aromatiques, la préparation intra-pharmaceutique de médicaments à usage externe contenant du goudron, de l'ichtyol, du soufre, de l'huile de Naftalan, du collodion, de l'eau de plomb, ainsi que des médicaments homéopathiques dont l'analyse ne peut être effectuée en pharmacie, s'effectue sous la supervision d'un pharmacien chargé du contrôle de la qualité des médicaments.
V. Contrôle organoleptique
1. Le contrôle organoleptique consiste à vérifier la forme galénique (y compris homéopathique) selon les indicateurs : "Description" (aspect, couleur, odeur), homogénéité, absence d'impuretés mécaniques visibles (dans les formes galéniques liquides). Le goût est testé sélectivement sur des formes galéniques destinées aux enfants.
2. L'homogénéité des poudres, des triturations homéopathiques, des pommades, des pilules, des suppositoires est vérifiée conformément aux exigences de la Pharmacopée d'État, des documents réglementaires en vigueur. Le contrôle est effectué de manière sélective chez chaque pharmacien au cours de la journée de travail, en tenant compte différents types formes galéniques.
3. Les résultats du contrôle organoleptique des formes galéniques sont enregistrés au journal selon la fiche jointe (Annexe 2 à de cette instruction).
Vi. Contrôle physique
1. Le contrôle physique consiste à vérifier la masse ou le volume total de la forme galénique, le nombre et la masse des doses individuelles (au moins trois doses) comprises dans cette forme galénique.
2. Vérifié :
3. chaque lot de conditionnement et de préparation intra-pharmaceutique à raison d'au moins trois conditionnements (y compris les conditionnements de produits industriels et de médicaments homéopathiques) ;
4. formes galéniques élaborées selon des prescriptions individuelles (exigences), sélectivement au cours de la journée de travail, en tenant compte de divers types de formes galéniques, mais pas moins de 3 % du nombre de formes galéniques produites par jour ;
5. chaque série de formes galéniques nécessitant une stérilisation, après remplissage avant stérilisation, en une quantité d'au moins cinq flacons (flacons) ;
6. le nombre de granules homéopathiques dans un certain poids de l'échantillon conformément aux exigences des documents réglementaires en vigueur.
7. Résultats contrôle physique sont inscrits au journal selon le formulaire ci-joint (Annexe 2 à la présente Instruction).
8. Lors du contrôle des formes galéniques, la qualité de la fermeture est également contrôlée.
VII. Contrôle chimique
1. Le contrôle chimique consiste à évaluer la qualité de fabrication d'un médicament selon les indicateurs suivants : « Authenticité », « Tests de pureté et limites admissibles d'impuretés » (analyse qualitative) et « Quantification » (analyse quantitative) des substances médicamenteuses incluses dans sa composition.
2. L'analyse qualitative est obligatoire :
3. Eau purifiée, eau pour injection tous les jours (de chaque cylindre, et lorsque l'eau est fournie par la canalisation à chaque lieu de travail) à l'absence de chlorures, sulfates et sels de calcium. L'eau destinée à la fabrication de solutions stériles, en plus des tests ci-dessus, doit être vérifiée pour l'absence de substances réductrices, de sels d'ammonium et de dioxyde de carbone conformément aux exigences de la pharmacopée d'État en vigueur. L'eau purifiée doit être envoyée au laboratoire de contrôle et d'analyse territorial sur une base trimestrielle pour une analyse chimique complète.
4. Tous les médicaments, concentrés et produits semi-finis (y compris les teintures homéopathiques, les triturations, les solutions, les dilutions) provenant des locaux de stockage vers la salle des assistants, et en cas de doute - les médicaments provenant de l'entrepôt de la pharmacie.
5. Concentrés, produits semi-finis et médicaments liquides dans une installation de burette et dans des rampes avec pipettes dans la salle assistante pendant le remplissage.
6. Médicaments production industrielle préconditionné en pharmacie, et une préparation intra-pharmacie réalisée et conditionnée en pharmacie (chaque lot).*
7.. L'analyse qualitative est effectuée de manière sélective :
huit. . Formes galéniques réalisées selon les prescriptions individuelles et les exigences des organisations médicales, chez chaque pharmacien pendant la journée de travail, mais pas moins de 10 % du nombre total de formes galéniques fabriquées. Différents types de formes posologiques doivent être testés. Une attention particulière est portée aux formes galéniques : pour les enfants ; utilisé dans la pratique oculaire; contenant des substances narcotiques et vénéneuses.
9. Série - une certaine quantité de un produit fini homogène (médicament) fabriqué en un cycle de production dans des conditions constantes.
10. Dilutions homéopathiques sélectives de la quatrième dilution décimale, contenant des substances biologiques toxiques et puissantes substances actives ou des composés inorganiques et organiques toxiques et puissants.
Onze. . Les résultats de l'analyse qualitative sont consignés dans les journaux selon les formulaires joints (Annexes 2,3,4 à la présente Instruction).
12. L'analyse qualitative et quantitative (contrôle chimique complet) est nécessairement soumise à :
13. . Toutes les solutions pour injections et perfusions avant stérilisation, y compris la détermination de la valeur du pH, les substances isotoniques et stabilisantes. Les solutions pour injection et perfusion après stérilisation sont vérifiées pour la valeur du pH, l'authenticité et le contenu quantitatif ingrédients actifs... Après stérilisation, les stabilisants contenus dans ces solutions sont contrôlés dans les cas prévus par les textes réglementaires en vigueur, notamment les guides méthodologiques. Pour le contrôle après stérilisation, un flacon de solution est prélevé sur chaque lot.
14. Solutions stériles à usage externe (solutions ophtalmiques pour l'irrigation, solutions pour le traitement des surfaces brûlées et plaie ouverte, pour administration intravaginale, etc.).
15. Collyres et onguents contenant des substances narcotiques et toxiques. Lors de l'analyse des gouttes ophtalmiques, la teneur en substances isotoniques et stabilisantes est déterminée avant la stérilisation.
16. Toutes les formes galéniques pour nouveau-nés *.
17.. Solutions de sulfate d'atropine et d'acide chlorhydrique (à usage interne), solutions de dichlorure de mercure et de nitrate d'argent.
dix-huit. . Tous les concentrés, produits semi-finis, triturations, y compris les dilutions homéopathiques liquides de substances médicinales inorganiques et organiques et leur trituration jusqu'à la troisième décimale de dilution**.
19. . Toute préparation intra-pharmacie de médicaments (chaque lot).
20. Stabilisants utilisés dans la fabrication de solutions injectables et solutions tampons utilisées dans la fabrication de collyres.
21. La concentration d'alcool éthylique lorsqu'il est dilué dans une pharmacie et, si nécessaire, lorsqu'il est prélevé dans un entrepôt.
22. À titre exceptionnel, la fabrication de formes galéniques de composition complexe pour nouveau-nés ne disposant pas de méthodes d'analyse qualitative et quantitative est réalisée sous la supervision d'un pharmacien-analyste ou d'un pharmacien-technologue.
23. Concentration d'alcool éthylique dans les solutions, dilutions et gouttes homéopathiques hydroalcooliques (chaque série).
24. Granulés homéopathiques à déliter (chaque lot) conformément aux exigences des documents réglementaires en vigueur.
25. Les analyses qualitatives et quantitatives (contrôle chimique complet) sont sélectivement soumises à :
26. Les formes posologiques fabriquées dans une pharmacie conformément aux prescriptions individuelles ou aux exigences des organisations médicales sont vérifiées à raison d'au moins trois formes posologiques lors du travail en une seule équipe, en tenant compte de divers types de formes posologiques. Une attention particulière est portée aux formes galéniques pour enfants : utilisées en pratique ophtalmique ; contenant des substances narcotiques et vénéneuses; solutions pour lavements médicinaux.
27. Les résultats du contrôle chimique complet sont consignés dans le journal selon le formulaire ci-joint (Annexe 2 à la présente Instruction). Tous les cas de fabrication insatisfaisante de médicaments sont obligatoirement enregistrés dans le journal.
